


生物体液中10种蟾蜍毒素的UPLC-MS/MS检测
曹振宇, 董颖, 刘剑, 张宏民, 苗丽文
生物体液中10种蟾蜍毒素的UPLC-MS/MS检测
Detection of 10 Bufotoxins in Biological Fluids Using UPLC-MS/MS
本文建立了人的血液、尿液中10种蟾蜍毒素(沙蟾毒精、日蟾蜍它灵、酯蟾毒精、去乙酰华蟾蜍精、酯蟾毒配基、华蟾毒它灵、蟾毒它灵、华蟾酥毒基、蟾毒灵、华蟾毒精醇)的超高效液相色谱-四极杆/静电场轨道阱高分辨质谱(UPLC-Q/Exactive MS)的检测方法。取血液或尿液0.2 mL,先加入0.8 mL乙腈沉淀蛋白,后用Hybird固相柱进行净化。选用ACQUITY UPLC HSS T3(2.1 mm×100 mm×1.8 µm)色谱柱,流动相A相为0.1%甲酸水,B相为乙腈,采用梯度洗脱分离。质谱采用电喷雾离子源,正离子模式进行分析。该方法在血液、尿液中对于10种蟾蜍毒素的检出限均可在10 ng/mL以内,最低可以达到0.1 ng/mL。10种蟾蜍毒素的血、尿基质添加在20~400 ng/mL范围内线性良好(R2>0.995)。血、尿中10种蟾蜍毒素的提取回收率在65.0%~97.7%之间,基质效应在90.8%~109.0%之间,日内精密度在9.6%之内,日间精密度在14.7%之内,在基质中的反复冻融稳定性、常温稳定性和提取后稳定性良好,浓度的RSD变化均在15%以内。用本文建立的方法对动物实验中收集到的血液进行分析,结果表明10种蟾蜍毒素均可检出。该方法灵敏度高,适用性广,可以用于蟾蜍毒素中毒类案件的检验鉴定。
A method was developed for the detection of 10 bufotoxins (arenobufagin, gamabufotalin, resibufagin, desacetylcinobufagin, resibufogenin, cinobufotalin, bufotalin, cinobufagin, bufalin, and cinobufaginol) in human blood and urine by ultra-high performance liquid chromatography-quadrupole/electrostatic field orbital trap high resolution mass spectrometry (UPLC-Q/Exactive MS). 0.8 mL of acetonitrile was added in 0.2mL of blood or urine to precipitate proteins, and then was purified with a Hybird solid phase column. A ACQUITY UPLC HSS T3 column (2.1 mm×100 mm×1.8 µm) was selected. The mobile phase A consisted of 0.1% formic acid in water and B consisted of acetonitrile with a gradient elution program for separation. The mass spectrum was analyzed by electrospray ion source and positive ion mode. The detection limit of 10 bufotoxins in blood and urine can be less than 10ng/mL, and the lowest can reach 0.1 ng/mL. The calibration curves of 10 bufotoxins were in good linear over the range from 20ng/mL to 400ng/mL (R2 > 0.995) in spiked blood and urine matrix. The extraction recoveries of 10 bufotoxins from blood and urine ranged from 65% to 97.7%, the matrix effect ranged from 90.8% to 109.0%, the intraday precision was within 9.6%, and the interday precision was within 14.7%. The stabilities of 10 bufotoxins in the matrix were good under repeated freezing and thawing condition, room temperature condition, and extraction processing, with the RSD of concentration all within 15%. The method was used to analyze the body fluids collected in animal experiments. The results showed that all 10 bufotoxins had been detected. This method has high sensitivity and broad applicability, and can be used for the identification in bufotoxin poisoning cases.
法医毒物分析 / 蟾蜍毒素 / 生物样本 / 质谱检测 {{custom_keyword}} /
forensic toxicology analysis / bufotoxin / biological samples / mass spectrometry detection {{custom_keyword}} /
表1 液相色谱梯度洗脱条件Table 1 Gradient elution conditions of liquid chromatography |
| 时间/min | 流动相A/% | 流动相B/% |
|---|---|---|
| 0.0 | 90 | 10 |
| 0.8 | 90 | 10 |
| 2.0 | 70 | 30 |
| 12 | 60 | 40 |
| 14 | 10 | 90 |
| 16 | 10 | 90 |
| 16.1 | 90 | 10 |
| 18 | 90 | 10 |
表2 10种蟾蜍毒素的基本信息及质谱条件Table 2 Basic information and mass spectrometry conditions of 10 bufotoxins |
| 序号 | 中文名 | 英文名 | 分子式 | 碰撞能 | [M+H]+精确质量 | 子离子精确质量 |
|---|---|---|---|---|---|---|
| 1 | 沙蟾毒精 | Arenobufagin | C24H32O6 | 43 | 417.2256 | 399.2146*、356.5407 |
| 2 | 日蟾蜍它灵 | Gamabufotalin | C24H34O5 | 40 | 403.2464 | 385.2362*、349.2151 |
| 3 | 酯蟾毒精 | Resibufagin | C24H30O5 | 35 | 399.2152 | 239.1783*、257.1889 |
| 4 | 去乙酰华蟾蜍精 | Desacetylcinobufagin | C24H32O5 | 43 | 401.2306 | 159.1166*、107.0858 |
| 5 | 酯蟾毒配基 | Resibufogenin | C24H32O4 | 30 | 385.2358 | 367.2275*、349.2162 |
| 6 | 华蟾毒它灵 | Cinobufotalin | C26H34O7 | 25 | 459.2360 | 363.1941*、201.1638 |
| 7 | 蟾毒它灵 | Bufotalin | C26H36O6 | 30 | 445.2569 | 349.2151*、367.2257 |
| 8 | 华蟾酥毒基 | Cinobufagine | C26H34O6 | 30 | 443.2412 | 365.2111*、215.1794 |
| 9 | 蟾毒灵 | Bufalin | C24H34O4 | 35 | 387.2515 | 255.2099*、351.2305 |
| 10 | 华蟾毒精醇 | Cinobufaginol | C26H34O7 | 30 | 459.2362 | 151.0386*、363.1945 |
| 注:*为定量离子。 |
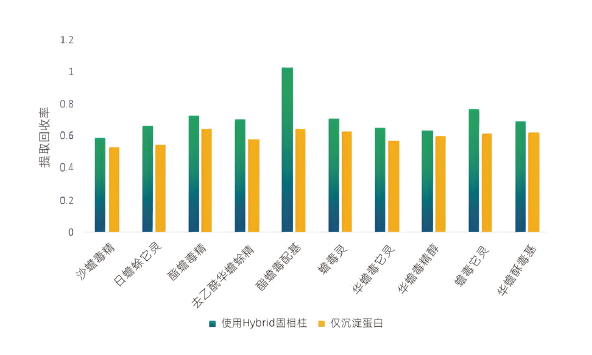
图1 血液中不同前处理方式的回收率比较Fig.1 Comparison of recoveries by different pretreatment methods in blood |
表3 血、尿添加样品中10种蟾蜍毒素的线性范围、线性方程、决定系数、检出限及定量限Table 3 The linear ranges, linear equations, coefficients of determination, LODs and LOQs of 10 bufotoxins in blood and urine |
| 毒素名称 | 基质 | 线性范围/(ng/mL) | 线性方程 | 决定系数/R2 | LOD/(ng/mL) | LOQ/(ng/mL) |
|---|---|---|---|---|---|---|
| 沙蟾毒精 | 血 尿 | 20~400 20~400 | y=1956.4x-20853 y=1956.4x-20853 | 0.9953 0.9952 | 10 10 | 20 20 |
| 日蟾蜍它灵 | 血 尿 | 20~400 10~400 | y=8089.9x+424451 y=10274x+80115 | 0.9962 0.9981 | 1 1 | 20 10 |
| 酯蟾毒精 | 血 尿 | 10~400 10~400 | y=22022x+228144 y=19301x+319262 | 0.9952 0.9980 | 1 1 | 10 10 |
| 去乙酰华蟾蜍精 | 血 尿 | 10~400 10~400 | y=32862x+218242 y=26986x+498974 | 0.9967 0.9955 | 1 1 | 10 10 |
| 酯蟾毒配基 | 血 尿 | 10~400 10~400 | y= 9184x+141759 y=7204.2x+123602 | 0.9980 0.9972 | 1 1 | 10 10 |
| 华蟾毒它灵 | 血 尿 | 10~400 10~400 | y=6536.1x+49370 y=5117.1x+69073 | 0.9977 0.9970 | 1 1 | 10 10 |
| 蟾毒它灵 | 血 尿 | 10~400 10~400 | y=31772x+369332 y=31781x+892179 | 0.9968 0.9970 | 1 1 | 10 10 |
| 华蟾酥毒基 | 血 尿 | 10~400 10~400 | y=12912x+129771 y=10102x+106545 | 0.9994 0.9954 | 1 1 | 10 10 |
| 蟾毒灵 | 血 尿 | 10~400 10~400 | y=27920x+478512 y=25499x+518353 | 0.9982 0.9963 | 0.1 0.1 | 10 10 |
| 华蟾毒精醇 | 血 尿 | 10~400 10~400 | y=10922x+166195 y=10681x+230745 | 0.9962 0.9960 | 1 1 | 10 10 |
表4 血、尿样本中10种蟾蜍毒素的回收率Table 4 The recoveries of 10 bufotoxins in blood and urine |
| 毒素名称 | 血液中回收率/% | 尿液中回收率/% | |||
|---|---|---|---|---|---|
| 20 ng/mL | 400 ng/mL | 20 ng/mL | 400 ng/mL | ||
| 沙蟾毒精 | 77.4 | 76.3 | 93.6 | 86.8 | |
| 日蟾蜍它灵 | 71.1 | 75.0 | 76.0 | 83.0 | |
| 酯蟾毒精 | 73.2 | 82.9 | 80.7 | 95.4 | |
| 去乙酰华 蟾蜍精 | 77.8 | 83.7 | 85.9 | 90.3 | |
| 酯蟾毒配基 | 74.6 | 65.0 | 74.2 | 68.6 | |
| 蟾毒灵 | 81.3 | 88.9 | 82.9 | 76.4 | |
| 华蟾毒它灵 | 74.3 | 80.2 | 67.4 | 75.7 | |
| 蟾毒它灵 | 75.2 | 75.9 | 85.8 | 84.3 | |
| 华蟾酥毒基 | 86.7 | 70.3 | 84.6 | 71.8 | |
| 华蟾毒精醇 | 84.4 | 85.1 | 97.7 | 89.5 | |
表5 血、尿样本中10种蟾蜍毒素的基质效应Table 5 Matrix effects of 10 bufotoxins in blood and urine |
| 毒素名称 | 血液基质效应/% | 尿液基质效应/% | |||
|---|---|---|---|---|---|
| 20 ng/mL | 400 ng/mL | 20 ng/mL | 400 ng/mL | ||
| 沙蟾毒精 | 105.7 | 101.5 | 104.7 | 99.2 | |
| 日蟾蜍它灵 | 102.9 | 96.9 | 90.8 | 105.5 | |
| 酯蟾毒精 | 99.0 | 99.4 | 96.0 | 108.2 | |
| 去乙酰华 蟾蜍精 | 100.5 | 94.6 | 97.8 | 108.7 | |
| 酯蟾毒配基 | 102.2 | 101.2 | 98.6 | 91.2 | |
| 蟾毒灵 | 98.4 | 92.0 | 108.2 | 101.0 | |
| 华蟾毒它灵 | 101.3 | 98.7 | 98.6 | 103.2 | |
| 蟾毒它灵 | 106.3 | 103.3 | 94.4 | 95.9 | |
| 华蟾酥毒基 | 99.1 | 94.7 | 104.0 | 94.8 | |
| 华蟾毒精醇 | 101.9 | 95.7 | 94.3 | 102.2 | |
表6 血、尿样本中10种蟾蜍毒素的日内、日间精密度Table 6 Intraday and interday precisions of 10 bufotoxins in blood and urine |
| 毒素名称 | 添加浓度/(ng/mL) | 血中精密度/% | 尿中精密度/% | |||
|---|---|---|---|---|---|---|
| 日内RSD | 日间RSD | 日内RSD | 日间RSD | |||
| 沙蟾毒精 | 20 100 400 | 9.1 9.4 7.2 | 12.0 11.5 13.4 | 6.5 4.4 5.8 | 11.0 8.3 7.4 | |
| 日蟾蜍它灵 | 20 100 400 | 8.5 9.4 7.0 | 9.2 10.4 13.8 | 8.9 8.5 7.2 | 12.5 10.5 13.3 | |
| 酯蟾毒精 | 20 100 400 | 6.4 4.8 6.9 | 7.1 11.6 8.0 | 5.4 5.0 6.9 | 11.2 11.6 14.6 | |
| 去乙酰华蟾蜍精 | 20 100 400 | 7.1 6.8 7.3 | 9.0 10.8 11.3 | 4.2 4.7 7.2 | 8.4 9.7 8.6 | |
| 酯蟾毒配基 | 20 100 400 | 7.0 4.6 7.4 | 12.4 12.7 9.1 | 6.0 8.6 3.9 | 8.3 12.1 13.4 | |
| 蟾毒灵 | 20 100 400 | 5.5 2.5 6.8 | 9.1 11.6 8.6 | 4.6 4.7 8.6 | 7.4 8.4 13.9 | |
| 华蟾毒它灵 | 20 100 400 | 4.9 5.2 6.1 | 11.7 8.7 9.3 | 7.9 8.9 6.1 | 11.7 13.3 6.7 | |
| 蟾毒它灵 | 20 100 400 | 6.0 3.3 6.0 | 6.9 6.0 6.9 | 5.9 4.8 8.1 | 8.9 5.6 10.1 | |
| 华蟾酥毒基 | 20 100 400 | 5.6 4.1 7.8 | 9.3 13.4 12.8 | 7.5 9.6 6.6 | 7.9 11.7 14.7 | |
| 华蟾毒精醇 | 20 100 400 | 4.9 7.4 6.9 | 11.6 8.2 7.6 | 7.0 2.0 6.9 | 9.3 7.7 14.0 | |
| [1] |
邓莎, 李梦园, 武小玲, 等. 蟾酥化学成分及抗肿瘤作用研究进展[J]. 中成药, 2022, 44(3): 884-890.
(
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [2] |
邱文艳, 陈思雅, 颜红, 等. 蟾毒灵抗肝肿瘤活性及靶向载药系统研究进展[J]. 湖南中医杂志, 2023, 39(5): 189-193.
(
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [3] |
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [4] |
王元清, 严建业, 罗堃, 等. 蟾皮提取物抑菌活性与稳定性研究[J]. 食品与机械, 2011, 27(5): 120-122.
(
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [5] |
周钒, 杨届. 蟾蜍的药用价值研究进展[J]. 湖南中医杂志, 2015, 31(11): 203-204.
(
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [6] |
曹振宇, 董颖. 蟾蜍毒素研究进展[J/OL]. 刑事技术 [2023-06-23]. https://doi.org/10.16467/j.1008-3650.2023.0047.
(
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [7] |
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [8] |
李兴平, 雷玲, 胡竟一, 等. 蟾酥的急性毒性和丹羚心舒胶囊急性毒性研究[J]. 中药药理与临床, 2012, 28(6): 127-129.
(
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| [9] |
赵伟, 孙国志. 不同种实验动物间用药量换算[J]. 畜牧兽医科技信息, 2010(5): 52-53.
(
{{custom_citation.content}}
{{custom_citation.annotation}}
|
| {{custom_ref.label}} |
{{custom_citation.content}}
{{custom_citation.annotation}}
|
 表1 液相色谱梯度洗脱条件
表1 液相色谱梯度洗脱条件 表2 10种蟾蜍毒素的基本信息及质谱条件
表2 10种蟾蜍毒素的基本信息及质谱条件 图1 血液中不同前处理方式的回收率比较
图1 血液中不同前处理方式的回收率比较 图2 尿液中不同前处理方式的回收率比较
图2 尿液中不同前处理方式的回收率比较 图3 10种蟾蜍毒素的色谱图
图3 10种蟾蜍毒素的色谱图 图4 空白血样提取后色谱图
图4 空白血样提取后色谱图 图5 空白尿样提取后色谱图
图5 空白尿样提取后色谱图 表3 血、尿添加样品中10种蟾蜍毒素的线性范围、线性方程、决定系数、检出限及定量限
表3 血、尿添加样品中10种蟾蜍毒素的线性范围、线性方程、决定系数、检出限及定量限 表4 血、尿样本中10种蟾蜍毒素的回收率
表4 血、尿样本中10种蟾蜍毒素的回收率 表5 血、尿样本中10种蟾蜍毒素的基质效应
表5 血、尿样本中10种蟾蜍毒素的基质效应 表6 血、尿样本中10种蟾蜍毒素的日内、日间精密度
表6 血、尿样本中10种蟾蜍毒素的日内、日间精密度/
| 〈 |
|
〉 |