第一作者简介:魏孙祥,男,河南确山人,硕士研究生,研究方向为法医遗传学。E-mail: 1158673871@qq.com
本文建立双重数字PCR检测miR-891a-5p和内参基因RNU6b鉴定精液的方法,并评估其对实际案件的检验能力。通过设计5’端不同荧光修饰的TaqMan MGB探针,建立检测miR-891a-5p和RNU6b的双重数字PCR方法,对5种体液(包括精液、外周血、月经血、唾液、阴道分泌液)共107份样本进行检测,以非参数检验和ROC曲线分析评价所建方法鉴别精液的能力;进行灵敏度试验并制备不同比例的混合斑、模拟降解精斑等测试体系的准确性。结果表明,精液miR-891a-5p表达水平显著高于其他体液( P<0.0001),其与内参基因RNU6b的表达情况证实方法能够实现100%的精液鉴定。所有测试条件下的样本(包括0.008 µL的微量精液、按1︰100与其他4种体液混合的精斑以及室外放置14 d、紫外照射24 h或洗涤过的精斑等)均被正确鉴别。本研究成功建立了一种基于数字PCR技术准确、灵敏地鉴定精液的方法,显示出良好的鉴别能力和应用前景,可在法医实际检案中广泛应用。
A method was here to establish about digital dual-plex PCR to detect miR-891a-5p and reference gene RNU6b for semen identification, successively having its practical case-oriented applicability evaluated. TaqMan MGB probes were adopted and modified at their 5’ ends with different fluorescent substances so as to realize the digital dual-plex PCR detection of miR-891a-5p and RNU6b. The detection was carried out with a total of 107 samples from 5 body fluids (semen, peripheral/menstrual blood, saliva and vaginal secretions). Both non-parametric test and ROC curve analysis were to evaluate the method’s ability to identify semen. Sensitivity test was consecutively performed, with the accuracy being assessed through the mixed stains (preparations of different proportions from semen and other four body fluids) and the mock degraded seminal stains. miR-891a-5p demonstrated significantly higher expression level in semen than in other body fluids ( P˂0.0001), having achieved accurate (100%) semen discrimination from the other fluids according to its expressions and reference gene RNU6b. The tested samples showed that they were all able to be correctly identified with 0.008 µL trace semen, mixed seminal stains with the other 4 body fluids at 1︰100, and those that were placed outdoors for 14 days, irradiated under UV for 24 hours and/or undergone into being washed. An accurate and sensitive semen identification approach has been here successfully established with digital PCR technology, demonstrating good identification ability and application prospect, hence capable of being widely exploited in practical forensic cases.
准确识别案发现场体液斑迹的组织属性对于犯罪现场的重建、案件性质的确定等具有重要价值, 是法医物证学的重要研究内容[1]。精液斑是法医实践中常见的生物检材, 强奸、猥亵等案件常常涉及精液鉴定。传统的精液鉴定方法包括化学法、酶催化法、光谱法和免疫学法等, 这些方法都有其局限性, 如对检材完整性要求高、灵敏度和特异性各异、检验结果不稳定等[2]。微RNA(microRNA, miRNA)是一种长度为18~25 nt的非编码小分子RNA, 其表达具有高保守性、时序性和良好的组织特异性, 有望通过对其表达量的检测为精斑确证提供一种分子生物学新途径[3, 4, 5]。大量研究表明miR-891a-5p具有良好的精液特异性[6, 7, 8], 通过检测其表达量可进行精液鉴定; RNU6b在不同个体的不同体液类型中均具有较高的表达水平且相对稳定, 是目前基于miRNA的体液鉴定广泛使用的内参基因[3, 9, 10]。
本研究建立了可同时检测miR-891a-5p和内参基因RNU6b的双重数字PCR检测体系, 实现精液斑的100%准确鉴别, 具有很好的法医学实践与应用前景。
1.1.1 实验仪器
数字PCR以QX200 AutoDG微滴式数字PCR系统(Bio-Rad, 美国)运行, 该设备包括自动化微滴生成器、PX1 PCR反应板热封仪、带96深孔反应模块的C1000 Touch热循环仪和QX200微滴读取器。
1.1.2 引物、探针设计与合成
miR-891a-5p、内参基因RNU6b序列信息及引物探针序列见表1。本研究所用引物、探针为自行设计, 由生工(上海)生物科技有限公司合成。
| 表1 miR-891a-5p、RNU6b序列信息及引物、探针序列 Table 1 Sequences of miR-891a-5p and RNU6b and their primers/probes |
1.1.3 样本制备
本研究采集中国北方地区年龄在25~35岁无关志愿者的精液、外周血、月经血、唾液、阴道分泌液样本共107份, 其中包括67份精液样本、10份外周血样本、10份月经血样本、10份唾液样本、10份阴道分泌液样本。样本采集由公安部鉴定中心伦理委员会审查通过, 所有志愿者均已签署知情同意书。全部样本采集按研究要求和相关操作规范进行, 制备处理后均储存于-80 ℃备用。
1.2.1 RNA提取和定量
按照miRNeasy Mini Kit(Qiagen, 德国)操作说明书提取总RNA[11], 洗脱体积统一至30 µL; 使用Nanodrop 2000c(Thermo Fisher Scientific, 美国)测定总RNA的浓度和纯度(A260/280)。
1.2.2 cDNA合成
按照TaqMan® MicroRNA Reverse Transcription Kit(Thermo Fisher Scientific, 美国)使用说明书进行逆转录。实验体系为:dNTP mix(100 mmol/L total)0.15 µL, MultiscribeTM RT enzyme(50 U/µL)1.00 µL, 10 ×RT Buffer 1.5 µL, RNase Inhibitor(20 U/µL)0.19 µL, miR-891a-5p逆转录茎环引物(1 µmol/L)、RNU6b逆转录引物(1 µmol/L)各0.75 µL, 无核酸酶水5.66 µL, 样本5 µL。反应条件为:16 ℃、30 min, 42 ℃、30 min, 85 ℃、5 min, 4 ℃保持。设置反转录阴性对照(用无核酸酶水取代反转录酶)。
1.2.3 微滴式数字PCR方法的建立和优化
1)生成微滴
双重数字PCR检测miR-891a-5p和内参基因RNU6b, 每24 µL反应体系包括ddPCR Supermix for Probes(No dUTP)12 µL, cDNA 1.6 µL, 特异性正向引物(终浓度900 nmol/L), 通用反向引物(终浓度900 nmol/L), 水解探针(终浓度250 nmol/L)。其中miR-891a-5p和RNU6b的引物配比为1︰1。设置阴性对照(使用去核酸酶的水代替cDNA作为模板)。将样品转移至96孔板中, 于自动化微滴生成器生成微滴, 并以另一96孔板接收生成的微滴。
2)PCR扩增
将接收生成微滴的96孔板盖膜、封膜, PCR扩增, 程序为:95 ℃、10 min, 45个热循环(94 ℃、30 s, 62~56 ℃、60 s, 72 ℃、30 s), 98 ℃、10 min, 4 ℃保持。升降温速度为2.0 ℃/s。
3)读取微滴
扩增完毕后, 在QX200微滴读取器上读取微滴数据, 采用QuantaSoft Software v.1.7.4(Bio-Rad, 美国)进行数据收集与分析。包含10 000个以上微滴的反应视作有效反应, 并用于数据分析。
4)检测体系的优化
主要从退火温度、引物探针设计、反应体系中引物探针浓度、热循环数等方面优化检测体系。使用带96深孔反应模块的C1000 Touch热循环仪温度梯度功能进行PCR扩增退火温度的优化(62~56 ℃)。设置退火温度梯度包括:62.0、61.6、60.9、59.8、58.4、57.3、56.5、56.0 ℃。
1.2.4 鉴别方法的建立
对全部107份样本进行miR-891a-5p和内参基因RNU6b的双重数字PCR检测, 其中:67份精液样本(58份精液、9份精斑), 40份非精液样本(10份外周血、10份月经血、10份唾液、10份阴道分泌液)。对精液样本, 42份取10 µL、16份取300 µL; 另9份以50 µL制成精斑。外周血6份取10 µL、4份取500 µL。唾液6份取10 µL、4份取2 mL。月经血和阴道分泌液经剪取2 cm2卫生棉提取制备。阳性微滴数小于2的反应视为阴性[12, 13], 拷贝数浓度计为“0”。对miR-891a-5p以及miR-891a-5p/RNU6b比值通过受试者工作特征曲线(receiver operating characteristic curve, ROC)作分析, 根据曲线下面积(area under the receiver operating characteristic curve, AUC)确定本检测体系鉴别能力以及最佳截断值。
1.2.5 鉴别方法的验证
1)灵敏度试验
3份精液样本从1 µL开始2倍梯度稀释, 共8个梯度, 稀释后取1 µL进行提取和检测, 即精液量分别为1.0、0.5、0.25、0.125、0.063、0.031、0.016、0.008 µL。同时使用金标抗人精检测试剂条PSA检测以作比较。
2)模拟混合斑样本的制备和检测
3份精液样本分别对应3份外周血、月经血、唾液、阴道分泌液样本进行1︰10、1︰50、1︰100混合斑的制作(外周血、月经血、唾液固定为200 µL, 分别取20、4、2 µL精液于棉签上进行混合; 阴道分泌液固定为2.5 cm2卫生棉, 分别取20、4、2 µL精液与之混合), 晾干后进行检测。
3)模拟降解精斑样本的制备和检测
模拟降解精斑样本的条件设置包括室外环境、紫外灯照射和洗涤, 每个测试条件下各3份样本分别取50 µL于棉签上晾干。
a)室外样本:放置于室外自然露天条件下0、4、8、14 d后进行检测;
b)紫外灯照射样本:放置于紫外灯下照射0、4、8、24 h后进行检测;
c)洗涤样本:“蓝月亮”牌洗衣液浸泡10 min, 自来水冲洗20 s后进行检测。
1.2.6 数据分析
使用GraphPad Prism 9.0(GraphPad Software, 美国)软件进行统计学分析。精液与其他常见体液表达差异性分析使用非参数检验(Mann-Whitney U检验), P< 0.05表示差异有统计学意义; 利用ROC曲线以及miR-891a-5p/RNU6b比值评估miR-891a-5p区分精液的能力并获得鉴别的最佳截断值。
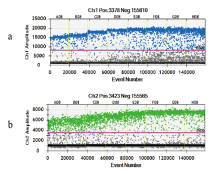
如“1.2.3”所述, 经反应条件的优化, 最终将正向引物及反向引物的终浓度设置为900 nmol/L, 探针终浓度设置为250 nmol/L, 热循环数设置为45。经退火温度梯度试验(62~56 ℃), 根据两个检测通道阳性微滴和阴性微滴的分离状态(如图1所示), 将退火温度优化为59.8 ℃(D08)。
本研究将5种体液共107份样本用于建立鉴别方法, 提取后总RNA浓度和纯度以及双重数字PCR检测结果见补充材料表S1。5种体液所有样本内参基因RNU6b均为阳性。所有精液样本均能检测出miR-891a-5p且表达水平较高(1.70~2 890.00 copies/µL); 少数非精液样本(6/40)在总RNA浓度较高时能检测到miR-891a-5p, 但含量极低(≤0.69 copies/µL)。经非参数检验(Mann-Whitney U检验), miR-891a-5p以及miR-891a-5p/RNU6b比值(即内参归一化后的miR-891a-5p表达量)在精液中均显著高于其他体液, P值均小于0.000 1, 具有显著性差异。
经ROC曲线分析(图2), miR-891a-5p以及miR-891a-5p/RNU6b比值区分精液与非精液的能力均为100%(AUC=1.000), 即通过miR-891a-5p的绝对定量或相对表达量均可实现对精液样本的准确鉴别。
 | 图2 ROC曲线分析(a:miR-891a-5p; b:miR-891a-5p/RNU6b比值)Fig.2 Analysis of ROC curve (a: miR-891a-5p; b: ratio of miR-891a-5p/RNU6b) |
miR-891a-5p最佳截断值为1.195 copies/µL, miR-891a-5p/RNU6b比值最佳截断值为5.48×10-4, 此时灵敏度和特异性均为100%, 灵敏度95%置信区间(confidence interval, CI)为[94.58%, 100.0%], 特异性95% CI为[91.24%, 100.0%]。
据此, 将本研究精液斑鉴定的原则总结如下:
1)若miR-891a-5p> 1.195 copies/µL, 则可直接通过miR-891a-5p的绝对含量认定样本中含有精液成分。
2)若miR-891a-5p≤1.195 copies/µL, 则需结合内参基因计算miR-891a-5p/RNU6b比值以获取相对表达量, 若miR-891a-5p/RNU6b> 5.48×10-4, 则认为该样本或含精液; 若miR-891a-5p/RNU6b≤5.48×10-4, 则可认为该样本非精液(或低至不能检测出)。
根据以上鉴定标准, 用于建立本方法的所有107份样本均被100%正确判别。
2.3.1 灵敏度试验
本研究对3份精液样本进行了精液量从1 µL到0.008 µL的提取和检测, 结果见补充材料表S2所示。根据2.2中的鉴定标准, 使用本方法当精液量低至0.008 µL时, 所有样本仍都能被正确鉴定为精液。而传统方法金标抗人精检测试剂条PSA在精液量为0.016 µL及至0.008 µL时阴性率为66.7%(4/6)。
2.3.2 模拟混合样本试验
本研究对3份精液样本与外周血、月经血、唾液、阴道分泌液按1︰10、1︰50、1︰100混合而成的斑迹进行检测, 结果见补充材料表S3。所有混合斑均可检测出miR-891a-5p且根据miR-891a-5p的绝对含量均能被正确鉴定为含有精液成分(miR-891a-5p > 1.195 copies/µL)。miR-891a-5p/RNU6b比值随着混合比例中精液成分的降低而逐渐下降。
2.3.3 模拟降解样本试验
本研究分别进行了室外样本、紫外灯照射样本和洗涤样本的制备和检测, 每个条件各使用3份来自不同个体的精斑样本, 检测结果见补充材料表S4。室外放置的精斑样本精液特异性成分miR-891a-5p在4 d时已显著降低, 且随着时间梯度逐渐减少, 而内参基因RNU6b则较为稳定; 较之于室外样本, 紫外灯照射的精斑miR-891a-5p含量随时间梯度的变化较小, 仅在从0 h到4 h下降较明显; 洗涤样本在洗涤后miR-891a-5p含量显著降低。根据本研究2.2中的精液斑鉴定原则, 所有模拟降解样本及对照样本均被正确判定为精液。
微滴式数字PCR(droplet digital PCR, ddPCR)是近年来逐渐发展成熟的一种分子检测技术, 与实时荧光定量PCR相比具有以下优势:
1)可对核酸分子进行绝对定量, 克服了相对定量检测中归一化和校准问题[14]。
2)在检测微量目标核酸时精确度、重复性和灵敏度更高[15, 16]。
3)对潜在PCR抑制剂相对不敏感, 更不易受扩增效率的影响[17], 并可进行多重检测。
本研究在前期工作的基础上建立了可同时检测两个目标分子miR-891a-5p与RNU6b的双重数字PCR检测体系, 该体系可将模板的使用量降低一半, 对于法医样本常为微量这一特点而言具有极其重要的意义。使用建立的双重检测体系对来自5种体液共107份样本进行了检测验证, 进一步证实了miR-891a-5p的精液特异性。基于两种目标分子的表达情况, 使用ROC分析确立了精液鉴别方法, 最终可实现精液与其他体液100%的准确区分。
本体系不仅包含了精液特异性分子miR-891a- 5p, 同时加入了内参基因RNU6b。内参的加入可以对miR-891a-5p的表达情况进行必要的归一化分析, 避免了因样本在RNA提取、逆转录和ddPCR过程中出现问题而造成的假阴/阳性概率, 同时大大提高了方法的灵敏度。使用NanoDrop 2000c对核酸进行初步定量是法医物证实验室常用方法, 但此方法对低浓度RNA样本的定量准确性较差[18, 19, 20, 21], 我们选择使用不同体积梯度的原始精液样本进行方法灵敏度的测试验证, 发现随着提取时精液量的降低, RNU6b和miR-891a-5p的数字PCR定量结果均呈现出明显的下降规律, 而NanoDrop 2000c测量的总RNA浓度并没有明显变化规律, 进一步证实了NanoDrop无法对低浓度核酸进行准确定量。而当精液量低于0.063 µL时, 大多数样本仅通过miR-891a-5p的绝对含量已经无法进行准确判别(miR-891a-5p< 1.195 copies/µL), 但此时通过内参基因进行校正后, 在精液量为0.008 µL时依然能够被正确判定为精液, 这使得本体系比传统PSA试纸条法更加灵敏。
在实验样本的检测中, 针对液体类样本(精液、外周血、唾液)设置了不同体积的原始体液样本(这就意味着体积越大模板的总量也越大)进行提取检测及后续分析, 发现原始样本体积的多少并不影响本体系的鉴别效果:当样本初始量相对较少时, 如同样为10 µL的精液、外周血和唾液, 所有外周血和唾液样本均不能检测到miR-891a-5p; 而当样本体积较大, 如多达500 µL外周血或2 mL唾液, 少数样本虽能够检出极少量的miR-891a-5p, 但使用内参基因对上样量进行归一化后依然可以作出准确判别, 而被检测到的极少量miR-891a-5p的样本, 在没有使用内参基因的方法中可能会被错判而成为假阳性样本。
犯罪现场所遗留的体液斑迹往往不仅微量, 而且可能是降解或混合物, 混合斑、降解样本的检测一直是法医体液鉴定的重点和难点[22]。在模拟降解样本的检测中, 室外放置14 d、紫外照射24 h及经洗涤的精斑均可被正确判别, 说明此种降解程度的样本依然适用于本鉴定方法。由于条件所限, 本研究未能对更多降解样本进行检测验证, 这将是下一步要重点开展的工作之一。而在模拟混合斑样本的检测中, 精液与其他4种常见体液1︰100比例混合后仍都能通过本体系检测出精液特征分子miR-891a-5p、且能正确认定为含有精液成分, 充分体现出所建方法在混合斑鉴定中也具有较大潜力。同时研究还发现miR-891a-5p/RNU6b比值随着混合比例中精液成分的降低而逐渐下降, 说明RNU6b在样本中的稳定性较好, 也一定程度上反映出RNU6b作为内参基因的适用性。
本研究成功建立了miR-891a-5p与内参基因RNU6b的双重数字PCR检测体系, 能够实现精液斑的100%准确鉴别, 灵敏度高, 且适用于混合斑和降解样本。因此, 本检测体系具有很好的应用前景, 可在法医实际案件中进行广泛应用。
与本文相关的补充数据见:http://www.xsjs-cifs.com/CN/abstract/abstract6992.shtml。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|