第一作者简介:杨秀秀,女,山西运城人,硕士研究生,研究方向为法医毒物动力学。E-mail: yangxiuxiu2023@163.com
本文旨在建立甲卡西酮大鼠腹腔注射染毒模型,观察甲卡西酮及其代谢物在大鼠体内的分布规律。SD大鼠分别经腹腔注射7.6、15.2、22.8 mg/kg的甲卡西酮,观察中毒症状,分别于注射5、15、30 min后处死解剖,立即取心、肝、脾、肺、肾、脑、胃组织、肌肉、睾丸和心血,高效液相色谱-串联质谱方法检测其中甲卡西酮及其代谢物卡西酮、麻黄碱和伪麻黄碱的含量。结果表明,各样本中甲卡西酮、卡西酮的含量分布特点主要为肾>肺、脾、肝、脑>胃组织、心、肌肉、心血、睾丸;在不同时间下,甲卡西酮的含量分布特点主要为15 min的含量﹥5 min的含量﹥30 min的含量,卡西酮的含量分布特点主要为30 min的含量﹥15 min的含量﹥5 min的含量。麻黄碱、伪麻黄碱主要分布在肾、肝、肺,其余组织含量基本相同。甲卡西酮及其代谢物在大鼠体内分布不均,肾检材中含量较高,可作为疑似甲卡西酮死亡案例分析的检材。
An intraperitoneal infection model was here established about methcathinone with rat as the experimental animal, and the distribution of both the drug itself and its metabolites was observed in the rat tissues. SD rats, the selected experimental animal, were divided into three groups that were injected of methcathinone via the intraperitoneal route under the respective dose of 7.6 mg/kg, 15.2 mg/kg and 22.8 mg/kg and successively monitored of their poisoning symptoms. The rats were put to death at 5 min, 15 min and 30 min after drug injection, with their heart, liver, spleen, lung, kidney, brain, stomach, muscle, testicle and heart blood being collected immediately. From the extractions of the above rat tissues, HPLC-MS/MS was to detect the distributed methcathinone and its metabolites: cathinone, ephedrine and pseudoephedrine. Few effects were found of dose on distribution patterns of methcathinone, cathinone, ephedrine and pseudoephedrine among the rat tissues. Kidney was shown of highest concentration for the four tested chemical substances. Within same tissue, methcathinone was always demonstrating highest concentration, leaving cathinone, ephedrine and pseudoephedrine being as the sequential followers. Both methcathinone and cathinone were exceeded over the limit of quantification with the tested blood at each dose, contrasting to ephedrine and pseudoephedrine being under the detection limit any time. The distributed methcathinone was sequentially concentrated as 15 min> 5 min> 30 min, the three time points for rat execution. Nevertheless, cathinone was shown concentrated at the order of 30 min> 15 min> 5 min. Ephedrine and pseudoephedrine were found of mainly distributing in kidney, liver and lungs. Therefore, both methcathinone and its metabolites were distributed in imbalance among the rat tissues. Kidney was of harboring concentration-highest methcathinone, eligible as the sample for forensic identification of abusing methcathinone or relevant poisoning death case.
近年来, 甲卡西酮(methcathinone)作为合成卡西酮类新精神活性物质的一种, 在世界范围内的滥用趋势逐渐上升[1, 2, 3]。从目前对于甲卡西酮的报道来看, 国内外学者主要就甲卡西酮的检测、药理学和毒理学作用、光学异构体及其对颅内刺激、学习记忆能力的影响等方面进行研究[2, 4, 5, 6, 7, 8, 9]。关于甲卡西酮代谢产物的研究, 有学者报道了甲卡西酮通过肝微粒体孵育出卡西酮, 也有关于甲卡西酮及其代谢物卡西酮、麻黄碱、伪麻黄碱的检测方法, 甲卡西酮的代谢途径研究等[10, 11, 12, 13, 14], 而关于甲卡西酮及其代谢物麻黄碱在体内的分布情况仅见于血浆和脑组织的研究[11]。因此, 本实验建立了甲卡西酮及其代谢物卡西酮、麻黄碱和伪麻黄碱在体内分布研究的动物模型, 观察甲卡西酮及其代谢物在SD大鼠体内的分布规律, 为甲卡西酮中毒案件的检材采取和法医学鉴定提供实验依据。
Agilent 1260 液相色谱-Agilent 6460 三重四极杆串联质谱仪(Agilent, 美国), Votex-genie2 涡旋混合器(Scientific Industries, 美国), Neofuge 15R 高速冷冻离心机(上海力申科学仪器有限公司), Milli-Q 纯水机(Millipore, 美国)。
1.0mg/mL的S-甲卡西酮、S-卡西酮、S, R(+)-麻黄碱、R, R(+)-伪麻黄碱、S, S(+)-伪麻黄碱、氘代甲卡西酮(D3-Methcathinone)均购于美国Sigma-Aldrich; 甲卡西酮动物实验用药(甲卡西酮含量95%)由公安部禁毒情报技术中心国家毒品实验室提供, 其余试剂均为色谱纯。
甲卡西酮、卡西酮、麻黄碱、伪麻黄碱标准品分别用甲醇稀释至100 μ g/mL, MC-D3内标溶液用乙腈稀释至 100 μ g/mL, 储存于﹣20 ℃冰箱备用。
雄性SD大鼠60只, 体重220 g± 20 g, 购自斯贝福(北京)生物技术有限公司。大鼠禁食不禁水12 h, 随机分为A、B、C和对照组四组, 每组6只。其中A、B、C组分别按照7.6、15.2、22.8 mg/kg经腹腔注射甲卡西酮, 对照组经腹腔注射与A、B、C同等体积的生理盐水1 mL[15]。各组大鼠分别于给药后5、15、30 min处死, 解剖取心、肝、脾、肺、肾、脑、胃组织、肌肉、睾丸和心血置于﹣80 ℃冰箱内保存待检。以上动物实验已通过山西医科大学动物伦理委员会审查。
分别取固体检材100 mg剪碎或血液100 μ L, 置于1.5 mL塑料离心管中, 加入内标 MC-D3(500 ng/mL)10 μ L, 甲醇 500 μ L, 涡旋混合30 s, 以离心半径10 cm、转速13 000 r/min冷冻离心 10 min, 取上清液 400 μ L, 用0.22 μ m微孔滤膜过滤, 过滤液取5 μ L液相色谱质谱联用分析[14]。
1.5.1 色谱条件
色谱柱:Agilent InfinityLab Poroshell 120 Chiral-V(4.6 mm× 100 mm× 3.5 μ m); 流动相:由含0.3%(质量分数)甲酸铵的甲醇溶液与乙腈溶液(体积比为 40:60)组成; 流速:0.5 mL/min; 进样量:5 μ L; 柱温:25 ℃; 分析时间:9 min。
1.5.2 质谱条件
离子化方式:电喷雾离子化(ESI+); 工作模式:多反应监测模式(MRM); 各目标化合物的质谱参数如表1中所示。
| 表1 目标化合物的MRM参数 Table 1 MRM parameters of targeted compounds |
采用 SPSS23. 0统计软件对数据进行t检验和方差分析, 结果采用均数± 标准差表示。
大鼠血液工作曲线:取空白血液样本100 μ L, 加入梯度浓度的甲卡西酮、卡西酮、麻黄碱和伪麻黄碱工作液, 配成质量浓度为10、20、50、100、200、250、500、1 000 ng/mL 的校正样品, 按 1.4 处理后进样分析。结果见表2。
| 表2 血液中甲卡西酮、卡西酮、麻黄碱、伪麻黄碱的工作曲线相关参数 Table 2 Working curves and scopes of blood-harbored methcathinone, cathinone, ephedrine and pseudoephedrine |
大鼠肝脏工作曲线:取空白肝脏样本100 mg, 加入梯度浓度的甲卡西酮、卡西酮、麻黄碱和伪麻黄碱工作液, 配成质量浓度为50、100、200、250、500、1 000、1 500、2 000 ng/g的校正样品, 按 1.4 处理后进样分析。结果见表3。
| 表3 肝脏中甲卡西酮、卡西酮、麻黄碱、伪麻黄碱的工作曲线相关参数 Table 3 Working curves and scopes of liver-harbored methcathinone, cathinone, ephedrine and pseudoephedrine |
收集对照组6只大鼠的空白肝脏, 进行基质效应的评估, 配制50、500 ng/g和2 μ g/g的低、中、高3个浓度的分析物标准溶液直接进样, 设定为a组; 取对照组大鼠空白肝脏按1.4处理后, 添加对应浓度低、中、高3个浓度的分析物标准溶液进样, 设定为b组。比较两组不同条件下的峰面积平均值(A), 基质效应=Ab/Aa, 结果见表4。使用空白肝脏添加标准工作液制作甲卡西酮、卡西酮、麻黄碱和伪麻黄碱梯度浓度为1、3、5、6、8、10、15、20 ng/g的基质加标样本后, 按照前文所述进行提取与检测, 对所得色谱图进行数据分析。所得目标峰信噪比(S/N)等于3时的基质加标浓度为最低检出限(LLOD), S/N=10时的浓度为最低定量限(LLOQ)。结果见表4。
| 表4 甲卡西酮、卡西酮、麻黄碱、伪麻黄碱的最低检出限、最低定量限与基质效应 Table 4 LLODs, LLOQs and matrix effects for the method to test methcathinone, cathinone, ephedrine and pseudoephedrine |
每个批次中制作浓度分别为50 ng/g(工作曲线范围下限)、500 ng/g(工作曲线范围中段)和2 μ g/g(工作曲线范围上限)的质控样本, 每个浓度制备6个平行样本, 共进行5个批次的处理与检测。前3个批次分别在同一天内的早、中、晚, 进行样品处理与检测。后两个批次分别在接下来的两天的中午进行处理和检测。
精密度以相对标准偏差(RSD)表示。所得的数据经处理后得出各样本的相对回收率(相对回收率=工作曲线计算得浓度/理论浓度× 100%), 以各浓度的相对回收率的均值表示方法的批内与批间准确度。评估批内精密度、准确度与批间精密度、准确度的结果见表5。
| 表5 甲卡西酮、卡西酮、麻黄碱、伪麻黄碱的检测方法的精密度和准确度 Table 5 Precision and accuracy for the method to test methcathinone, cathinone, ephedrine and pseudoephedrine |
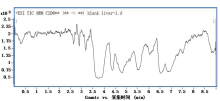
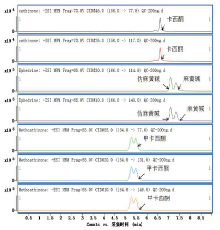
收集对照组6只大鼠的空白肝脏, 进行选择性的评估。其中空白基质的检测谱图见图1, 在目标化合物的保留时间内, 无干扰峰。而通过单标的基质加标谱图(图2、3), 发现目标化合物之间也无互相干扰。
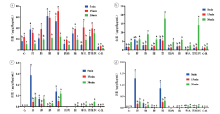
大鼠经过不同剂量的甲卡西酮腹腔注射后, 甲卡西酮原体及其代谢物卡西酮、麻黄碱、伪麻黄碱在其体内的分布规律不同, 不同组织脏器中甲卡西酮及其代谢物的浓度见表6~8。
| 表6 7.6mg/kg剂量下不同时间点中毒大鼠体内甲卡西酮、卡西酮、麻黄碱和伪麻黄碱的分布($\bar{x}± s$) Table 6 Tissue distribution of methcathinone, cathinone, ephedrine and pseudoephedrine detected at different time with the poisoned rats that were injected of methcathinone under a dose of 7.6mg/kg |
| 表7 15.2mg/kg剂量下不同时间点中毒大鼠体内甲卡西酮、卡西酮、麻黄碱和伪麻黄碱的分布($\bar{x}± s$) Table 7 Tissue distribution of methcathinone, cathinone, ephedrine and pseudoephedrine detected at different time with the poisoned rats that were injected of methcathinone under a dose of 15.2mg/kg |
| 表8 22.8mg/kg剂量下不同时间点中毒大鼠体内甲卡西酮、卡西酮、麻黄碱和伪麻黄碱的分布($\bar{x}± s$) Table 8 Tissue distribution of methcathinone, cathinone, ephedrine and pseudoephedrine detected at different time with the poisoned rats that were injected of methcathinone under a dose of 22.8mg/kg |
甲卡西酮在三个剂量组下, 不同时间点的含量变化为:在心、肺、肾、肌肉、脑、心血中, 15 min的含量﹥5 min的含量﹥30 min的含量; 肝中5 min的含量﹥15 min的含量﹥30 min的含量; 在脾中, 15.2和22.8 mg/kg剂量时5 min的含量﹥15 min的含量﹥30 min的含量, 7.6 mg/kg时15 min的含量﹥5 min的含量﹥30 min的含量; 睾丸中15 min的含量﹥30 min的含量﹥5 min的含量; 在胃组织中, 7.6 mg/kg时15 min的含量﹥5 min的含量﹥30 min的含量, 15.2 mg/kg时5min的含量﹥15min的含量﹥30min的含量, 22.8 mg/kg时15min的含量﹥30min的含量﹥5min的含量。
卡西酮在三个剂量组下, 不同时间点的含量变化为:在肺中, 15.2和22.8 mg/kg剂量时30 min的含量﹥15 min的含量﹥5 min的含量, 7.6 mg/kg时30 min的含量﹥5 min的含量﹥15 min的含量; 在心、肾中, 7.6和15.2 mg/kg剂量时30 min的含量﹥15 min的含量﹥5 min的含量, 22.8 mg/kg时30 min的含量﹥5 min的含量﹥15 min的含量; 脾、肌肉、脑、睾丸、胃组织、心血中, 30 min的含量﹥15 min的含量﹥5 min的含量; 在肝中, 7.6和15.2 mg/kg剂量时5 min的含量﹥30 min的含量﹥15 min的含量, 22.8 mg/kg时30 min的含量﹥5 min的含量﹥15 min的含量。
麻黄碱在三个剂量组下, 不同时间点的含量变化为:在心、脾、脑、睾丸、胃组织、心血中相差不大(7.6 mg/kg时心、肌肉、胃组织均未检出, 睾丸和脑在5和15 min未检出, 脾在5 min未检出; 15.2 mg/kg时心和肌肉均未检出, 脑在5 min未检出; 22.8 mg/kg时肌肉在5和15 min未检出, 脑在5 min未检出); 在肾中, 15.2和22.8 mg/kg剂量时5 min的含量﹥30 min的含量﹥15 min的含量, 7.6 mg/kg时30 min的含量﹥5 min的含量﹥15 min的含量; 在肺中30 min的含量﹥5 min的含量﹥15 min的含量; 在肝中5 min的含量﹥30 min的含量﹥15 min的含量。
伪麻黄碱在三个剂量组下, 不同时间点的含量变化为:在肝、肾中15.2和22.8 mg/kg剂量时5 min的含量﹥30 min的含量﹥15 min的含量, 7.6 mg/kg时5 min的含量﹥15 min的含量﹥30 min的含量; 在肺中5 min的含量﹥30 min的含量﹥15 min的含量; 在心、脾、脑、睾丸、胃组织、心血中含量相差不大(7.6 mg/kg时心、肌肉、胃组织未检出, 睾丸和脑在5和15 min未检出; 15.2 mg/kg时在15 min心和肌肉未检出; 22.8 mg/kg时在15min肌肉未检出)。
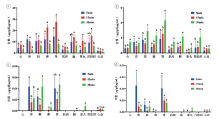
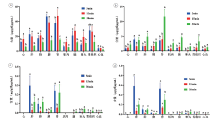
三个剂量组下不同时间点的含量分布结果见图4~6。从图中可以看出, 甲卡西酮的含量分布特点主要为15 min的含量﹥5 min的含量﹥30 min的含量, 卡西酮的含量分布特点主要为30 min的含量﹥15 min的含量﹥5 min的含量。麻黄碱、伪麻黄碱主要分布在肾、肝、肺, 其余组织含量基本相同。
甲卡西酮和卡西酮在体内的分布规律与剂量无关, 仅与时间相关。注射后5 min, 甲卡西酮在体内的分布特点为:脾、肾﹥肝、脑、胃组织﹥肺﹥心﹥睾丸、肌肉、心血; 卡西酮的分布特点为:肾、肝﹥肺﹥心、脾、脑、肌肉、胃组织﹥睾丸、心血。注射后15 min, 甲卡西酮的分布特点为:肾﹥脾﹥脑、胃组织、睾丸、肺、肝﹥心、肌肉﹥心血; 卡西酮的分布特点为:肾﹥肺、脾、肝﹥脑﹥胃组织、心、肌肉、心血﹥睾丸。注射后30 min, 甲卡西酮的分布特点为:肾﹥脾﹥胃组织、肺、脑、睾丸﹥心、肝﹥肌肉﹥心血; 卡西酮的分布特点为:肾﹥胃组织﹥肺﹥肝、脾﹥心、肌肉、脑﹥睾丸、心血。
麻黄碱和伪麻黄碱在体内的分布规律不但与时间相关, 而且与剂量相关。注射后5 min, 麻黄碱的分布特点为:7.6 mg/kg剂量组肾、肝﹥肺﹥心血, 在心、脾、肌肉、脑、睾丸、胃组织中未检出; 15.2 mg/kg剂量组肾、肝﹥肺﹥脾、睾丸、胃组织、心血, 在心、肌肉、脑中未检出; 22.8 mg/kg剂量组肝、肾、肺﹥脾、睾丸﹥心血、胃组织、心, 在肌肉、脑中未检出。伪麻黄碱的分布特点为:7.6 mg/kg剂量组肝、肾﹥肺﹥脾、心血, 在心、肌肉、脑、睾丸、胃组织中未检出; 15.2、22.8 mg/kg剂量组肝、肾﹥肺﹥脾、睾丸、脑、胃组织﹥心血、心、肌肉。注射后15 min, 麻黄碱的分布特点为:7.6 mg/kg剂量组肾﹥肝﹥肺﹥心血、脾, 在脑、心、肌肉、胃组织和睾丸中未检出; 15.2、22.8 mg/kg剂量组肾﹥肝﹥肺﹥脾﹥胃组织、睾丸﹥心血、脑﹥心, 在肌肉中未检出。伪麻黄碱的分布趋势为:7.6 mg/kg剂量组肾﹥肝﹥肺﹥心血、脾, 在脑、心、肌肉、胃组织和睾丸中未检出; 15.2、22.8 mg/kg剂量组肾﹥肝﹥肺﹥脾﹥胃组织、睾丸﹥心血、脑﹥心, 在肌肉中未检出。注射后30 min, 麻黄碱的分布特点为:7.6 mg/kg剂量组肾、肝、肺﹥脾、睾丸﹥心血、脑, 在心、肌肉、胃组织中未检出; 15.2 mg/kg剂量组肾、肝、肺﹥脾、睾丸、胃组织、脑、心血, 在心、肌肉中未检出; 22.8 mg/kg剂量组肾、肝、肺﹥胃组织、脾、睾丸、脑﹥肌肉、心、心血。伪麻黄碱的分布特点为:7.6 mg/kg剂量组肾、肺、肝﹥睾丸、脑、心血, 在心、脾、肌肉、胃组织中未检出; 15.2、22.8 mg/kg剂量组肾、肝、肺﹥睾丸、脾、脑、胃组织﹥心血、心、肌肉。
通过以上结果, 可以得出在相同时间点, 各个剂量组内, 甲卡西酮及其代谢物在体内的分布均为在肾中的含量最高。
本研究建立了甲卡西酮染毒大鼠的体内分布模型。大鼠经腹腔注射不同剂量的甲卡西酮后于5、15、30 min处死, 研究体内各脏器中药物的分布状态与剂量、时间的关系。通过前期的研究发现大鼠经过甲卡西酮腹腔注射后在血液中的甲卡西酮原体含量的达峰时间是15 min, 半衰期是30 min, 为了研究甲卡西酮及其代谢物卡西酮、麻黄碱和伪麻黄碱在体内的大致分布状态, 在甲卡西酮腹腔注射5、15、30 min时处死。此模型简单易复制, 可应用于甲卡西酮的法医毒物动力学研究[16]。
通过以上分析可以发现, 甲卡西酮、卡西酮、麻黄碱和伪麻黄碱在体内脏器的分布规律与剂量关系不大。甲卡西酮及代谢物卡西酮、麻黄碱、伪麻黄碱在体内的分布均是在肾脏内含量最高, 而在各脏器的分布中甲卡西酮原体的含量是最高的, 卡西酮次之, 麻黄碱和伪麻黄碱的含量很少。其中, 麻黄碱和伪麻黄碱在体内脏器中的检出是与剂量相关的。在不同剂量和不同时间点下, 血液中的甲卡西酮及卡西酮在各剂量下的含量均远高于定量限, 血液中麻黄碱和伪麻黄碱在各剂量下的含量均在检出限附近, 以上结果提示, 在疑似甲卡西酮吸毒或死亡的案件中, 血液可以作为检测相关人员是否吸毒的检材, 但应注意需要同时检测出甲卡西酮原体及其代谢物才可作为判定吸毒的依据。
药(毒)物在体内的分布是受多种复杂因素影响的动态变化过程, 影响因素包括药(毒)物的脂溶性、毛细血管通透性、器官和组织血流量、与血浆蛋白和组织蛋白的结合能力、药物pKa和局部pH值、药物转运载体数量和功能状态、特殊组织膜的屏障作用等[16]。
从总体分析来看, 甲卡西酮及其代谢物在肾、脾、肝、肺等脏器中的含量较高, 而在心、心血、肌肉等组织中的含量较低。甲卡西酮的脂溶性较高, 从以上分析来看, 其含量在体内的分布受脂溶性的影响较高。因而, 在实际甲卡西酮中毒案件中, 检材提取应以肾、脾、肝、肺等作为毒物分析的检材。
本研究建立的方法前处理简便, 通过有机溶剂沉淀蛋白而实现对目标物质的检测。该方法实现了同时对甲卡西酮及其代谢物卡西酮、麻黄碱和伪麻黄碱的定性定量分析。方法的灵敏度和检出限都较好, 有利于对此类案件进行快速检测。通过以上分析结果可以得出, 在不同剂量以及不同时间点下甲卡西酮及其代谢物卡西酮、麻黄碱和伪麻黄碱在肾中的含量均高于其他内脏组织, 因而提示在实际案件中应提取以肾为主的检材进行分析检测。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|