第一作者简介:江煜灵,男,广东清远人,硕士,主检法医师,研究方向为法医物证。E-mail: 86022846@qq.com
目的 通过对X-Pure 96 Plus微量DNA自动提取工作站用硅珠法及磁珠法(磁棒式)两种提取方法测试,探讨该工作站的提取灵敏度、纯化能力和对检材的适应性。方法 以2800M标准DNA及新鲜人血制作样本,经X-Pure 96 Plus微量DNA自动提取工作站对所选两种方法的提取灵敏度及纯化能力进行测试。结果 X-Pure 96 Plus工作站硅珠法及磁珠法两种提取方法的提取灵敏度和纯化能力都达到较高水平,硅珠法的纯化能力更强,而磁珠法的提取灵敏度稍优。结论 该工作站具有较强的纯化能力和提取效率,可针对不同检材选择合适的提取模式,能极大提升DNA提取的质量和效率。
Objective To verify the sensitivity and purification capability of X-Pure 96 Plus microDNA automatic extraction station and its adaptability with testing into two extraction methods (the magnetic beads and silicon beads).Methods X-Pure 96 Plus microDNA automatic extraction station was tested of its extraction sensitivity and purification ability with the samples of 2800M standard DNA and freshly-collected human blood to undergo into the selected two methods.Results Both the magnetic beads and silicon beads showed higher extraction sensitivity and purification ability with the X-Pure 96 Plus microDNA automatic extraction station, demonstrating the silicon beads tending to better purification ability while the magnetic beads to slightly better extraction sensitivity.Conclusions The workstation is of strong purification ability and extraction efficiency, suitable to have the appropriate extraction mode chosen according to different samples so that DNA extraction can have its quality and efficiency enhanced higher.
刑事案件现场遗留的生物物证日趋微量, 且常混有泥灰、油污等杂质(抑制物), 从而使相关DNA提取的难度加大, 故成功提取检材的DNA模板就成为检验的关键环节。目前有多种微量DNA的提取方法, 最常用的包括Chelex-100法、磁珠法、硅珠法、硅膜法、直扩法等。这些方法在实际应用中对检材具有一定的针对性, 不同种类的检材采用不同的方法其提取效果是不同的, 且不同方法的自动化实现程度也差异较大。
磁珠法作为目前主流的DNA提取方法, 由于其提取灵敏度较高, 对抑制物的去除能力较强且易于自动化, 故得到了广泛的应用[1, 2]。硅珠法在脱落细胞等微量生物检材以及骨骼、牙齿等疑难生物检材提取中的成功应用亦为很多学者所肯定[3, 4]。但由于硅珠不易富集, 需人工离心操作才能避免洗涤过程所导致的较大DNA损失, 故使得硅珠法的自动化研发较慢[5]。X-Pure 96 Plus工作站内置有离心机, 集成了硅珠法和磁棒式磁珠法两种提取方法, 对检材的适应性因而得以增强。本研究通过模拟样本测试及案件检材检验, 评价该工作站在DNA提取质量和效率上的应用效能。
TraceMag微量DNA磁珠纯化试剂盒(磁棒式)、TraceSili微量DNA硅珠纯化试剂盒、X-Pure 96 Plus微量DNA自动提取工作站(高盛智造, 中国), Promega PowerPlex21试剂盒(Promega, 美国), 全自动96道微量DNA提取工作站(博坤生物, 中国), ABI-Veriti96 Well Fast Thermal Cycler扩增仪、ABI-3500xl遗传分析仪(Life Technologies, 美国)。
采集志愿者新鲜血液5 μ L加入4 995 μ L无菌纯水配制成一份千倍稀释血; 吸取10 μ L Promega PowerPlex21试剂盒中所带的2 800M(浓度为10 ng/μ L)样品, 加入990 μ L无菌纯水配制成一份浓度为0.1 ng/μ L的标准DNA溶液; 测试杂质包括:铁锈(生锈铁器上刮取)、果汁(果粒橙饮料常温放置两天后备用)、蓝色牛仔裤布条、油污(机动车发动机油)、白色墙灰、地上泥灰。
案件检材细分为3类:1)手足接触类:手印、脚印、汗斑以及作案工具上采集的擦拭物或粘取物等; 2)口腔接触类:瓶口拭子、吸管拭子、食物残渣、口罩等; 3)随身衣物类:衣裤、帽子、手套、皮带、眼镜等。
样品制备后, 按照相关纯化试剂盒各自说明书经工作站进行提取, 洗脱体积皆设定为50 μ L; 使用Promega PowerPlex21试剂盒进行扩增, 扩增体系为10 μ L, 体系配比为Primer∶ Mix∶ H2O∶ DNA模板=2∶ 2∶ 1∶ 5, 进行29个循环扩增; 使用ABI-3500xl遗传分析仪进行电泳分析, 上样缓冲液体系为Hi-Di™ 甲酰胺∶ 内标(liz500)=10∶ 1, 每孔加入10 μ L缓冲液+1 μ L扩增产物, 进样时间15 s, 电泳电压1.2 kV。
判定标准:1)内标峰标定正确, Ladder每个基因座的等位基因峰在规定范围内, 阳性分型正确, 阴性无基因峰, 图谱清晰; 2)峰高大于或等于100 RFU, 视为该基因座检出; 3)当检出基因座数达到13个或以上时, 该检材视为“ 检出” DNA分型; 4)结果为“ 检出” 的检材占检材总数的比例为检材“ 检出率” 。视为“ 检出” 的检材图谱上包括Amelogenin在内的所有检出基因座的峰高平均值定义为该图谱的平均峰高。
使用新鲜人血和标准DNA 2800M进行灵敏度测试。设计样本含量2800M:0.2、0.4、0.6、0.8 ng; 千倍稀释血:5、10、20 μ L, 每种含量配制6个平行实验样本, 分别使用工作站的硅珠法和磁珠法两种模式提取DNA, 经扩增、电泳后得到的基因座检出数和平均峰高如表1。
| 表1 使用硅珠法和磁珠法提取不同含量的2800M和千倍稀释血的基因座检出数和平均峰高 Table 1 The number of loci detected and the average peak height obtained from different contents of 2800M and/or 1000-dilution blood extracted with either the silicon beads or the magnetic beads |
根据表1, 对于标准物2800M, 应用硅珠法和磁珠法得到的基因座检出率差别不大, 当2800M含量达到0.6 ng时, 两种方法都能稳定得到全部21个基因座分型, 而在2800M含量较少时(0.2、0.4 ng), 磁珠法的基因座检出率比硅珠法稍高, 磁珠法的平均峰高值也比硅珠法的平均峰高值大。这是因为磁珠法的整个DNA提取过程是在一个管内进行, DNA吸附在磁珠表面上, 通过磁场与液体分离, 分离效率极高, DNA损失率低。
而对于硅珠法, DNA吸附于硅珠表面, 洗涤过程中DNA和洗涤液的分离需通过离心实现, 分离效率取决于离心的效果, 一些游离的硅珠因无法聚集沉淀而随着洗涤液的去除造成DNA的损失[6]。因此整体而言, 硅珠法的DNA损失率会比磁珠法稍高, 在DNA含量较少的时候就会出现掉峰的情况, 峰高也比较低。
对于千倍稀释血, 硅珠法的提取效率明显比磁珠好, 20 μ L千倍稀释血应用硅珠法可以稳定得到21个基因座分型, 而应用磁珠法只能得到平均16.7个基因座分型。原因或为:一方面硅珠比磁珠具有更小的粒径, 在相同的体积内, 硅珠具有更大的表面积, 硅珠表面的修饰会更加丰富[7, 8], 对于不同长度DNA片段的吸附会更加完整, 而磁珠表面修饰后所能吸附DNA的范围主要集中于中大片段, 人血经裂解后可能会发生片段断裂, 相对于磁珠法, 硅珠法能提取到更加完整的血液DNA片段; 另一方面, 血液成分十分复杂, 包括多种蛋白质、无机盐、酶等, 下面2.2节的测试显示硅珠法比磁珠法具有更好的杂质去除能力, 对于血液来说, 硅珠法能得到质量更好的DNA模板。
实际案件中的检材种类繁杂, 同类的检材在不同的环境中所含有的杂质种类及含量也不一致, 本实验采用6种案件常见的杂质进行模拟实验, 杂质使用量远大于实际案件检材杂质含量, 测试该平台在大剂量杂质下的纯化能力。6种杂质及使用量见表2, 实验用0.8 ng 2800M和20 μ L的千倍稀释血作为基础样本, 每组设置一个不添加杂质的纯净样本, 其余样本加入各种杂质分别使用硅珠法及磁珠法进行DNA提取, 全部实验平行进行3次, 得到的基因座平均检出数如图1、图2。
| 表2 杂质使用量 Table 2 Impurities spiked and usage |
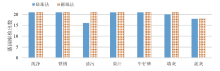 | 图1 各种杂质影响下的基因座检出数(2800M 0.8ng)Fig.1 Number of loci detected under the influence of various impurities on 2800M (0.8ng) |
 | 图2 各种杂质影响下的基因座检出数(稀释血20μ L)Fig.2 Number of loci detected under the influence of various impurities on the diluted blood (20μ L) |
由图1可以看出, 对于0.8 ng 2800M, 硅珠法和磁珠法检出率基本一致, 除了油污和泥灰外, 其余四种杂质都能检出20个以上的STR基因座(检出率> 95%), 与纯净样本的检出率相差不大, 说明两种方法的纯化能力都很好, 在含泥灰和油污的样品中, STR基因座检出数都大于16(检出率> 76%), 也能达到同一认定标准(13个STR基因座)。对于20 μ L的千倍稀释血(图2), 硅珠法对杂质的去除能力比较好, 效果由好到差为:铁锈> 牛仔裤> 果汁> 油污≈ 墙灰> 泥灰, 而磁珠法对杂质的去除能力相对来说稍差, 效果由好到差为:牛仔裤> 果汁> 铁锈≈ 泥灰> 墙灰> 油污。
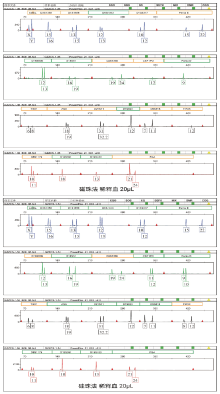
图3和图4是纯净样本分别使用硅珠法和磁珠法提取得到的电泳图谱, 当提取2800M(纯净标准DNA)时, 两种方法得到的图谱均衡性都很好, 当提取对象为人血(成分复杂, 含有各种蛋白、无机盐及酶)时, 两种方法得到的谱图均衡性也很理想, 但硅珠法相对较优, 这说明硅珠法去除杂质的能力较好, 能得到更纯的DNA模板。
X-Pure 96 Plus微量DNA自动提取工作站在本实验室实际使用已近1年, 案件接触类检材的提取主要用该工作站和全自动96道微量DNA提取工作站(博坤生物)共同完成。经统计近三个月接触类DNA检材的检验情况得到各类检材的检出率, 见表3。
| 表3 两种方法提取三类接触检材的检出率 Table 3 Detection rate of two different methods with three kinds of contact samples from cases |
在检材数量较大的情况下, 检材检出率具有统计学意义。表3共统计了2 664份检材的检验情况, 从手足接触类及随身衣物类检材的检验情况来看, 两台工作站的磁珠法检出率差异不大, 手足接触类检材检出率在35%~36%之间, 随身衣物类检材检出率在62%~64%之间, 而硅珠法对这两类检材的检出率明显较高, 分别达到40.51%和72.73%。而对于口腔接触类检材, 两台工作站、两种方法之间并无明显差异。综合来说, X-Pure 96 Plus磁珠法(总检出率42.49%)和全自动96道微量DNA(博坤生物)磁珠法(总检出率45.72%)检验提取效果无明显差异, 均达到了较高的提取纯化水平, 而X-Pure 96 Plus硅珠法(总检出率50.39%)的提取纯化水平则表现得更为优异。
本文测试了X-Pure 96 Plus微量DNA自动提取工作站两种提取方法, 即硅珠法和磁珠法的实验效果, 显示均达到了较高的纯化水平。具体而言, 磁珠法由于在分离过程中DNA损失率较硅珠法低, 其提取超微量DNA检材的灵敏度比硅珠法好, 但硅珠法去杂质的能力更好, DNA纯度更高, 所得到的图谱均衡性也更好。在实际检验中, 对于状况差、杂质多或腐败严重的检材, 可考虑优先使用硅珠法提取; 而状况一般、杂质不多的检材, 使用磁珠法则应会有更好的灵敏度; 对于微量血痕, 硅珠法比磁珠法更有优势。
综上所述, X-Pure 96 Plus微量DNA自动提取工作站具有较强的纯化能力和提取效率, 可根据检材的类型选择合适的提取方法, 以最大限度提升DNA提取的质量和效率。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|