第一作者简介:白雪,女,河北承德人,博士,主任法医师,研究方向为法医物证检验。E-mail: snowhome2004@126.com
目的 为GA118-24B遗传分析仪检测9色荧光STR扩增产物建立Matrix体系。方法 以pUC18载体为模板,设计引物扩增获得 9个荧光标记颜色、长度在75~190 bp之间的DNA片段。扩增产物经纯化和混合后,以GA118-24B遗传分析仪电泳得到DNATyper9C Matrix文件。结果 扩增所得的9个DNA片段长度分别为75、90、105、120、130、145、160、175和190 bp,所构建的Matrix文件能够有效消除不同荧光染料间的干扰和渗透。结论 建立了简单有效的Matrix构建方法,为新开发的国产化试剂使用GA118-24B遗传分析仪检测奠定了基础。
Objective To construct a matrix of nine-dye fluorescent system for STR genotyping that is to apply with GA118-24B genetic analyzer.Methods The pUC18 vector was selected as the target DNA, having the required primers designed to amplify DNA fragments that are of lengths among 75-190bp labeled with nine fluorescent dyes attaching onto the forward primer. After purified and mixed, the nine amplified DNA fragments were electrophoresed through GA118-24B genetic analyzer, accordingly having yielded the DNATyper9C matrix file.Results The nine fluorescent amplified fragments are the respective length of 75bp, 90bp, 105bp, 120bp, 130bp, 145bp, 160bp, 175bp and 190bp, demonstrating that the constructed matrix file is competent of effectively eliminating the interference and penetration between different fluorescent dyes.Conclusions A simple and effective matrix construction method has been established, having verified the availability of nine-dye fluorescent matrix system and its related file for STR genotyping so that a foundation has been laid for the newly-developed domestic reagent (i.e., the nine-dye fluorescent system) to apply with GA118-24B genetic analyzer.
基于毛细管电泳技术的遗传分析仪及STR复合扩增检测试剂是法医物证检验的重要手段, 个体识别和亲权鉴定多赖之实现。目前, 国内外公司主流产品为5~6色荧光STR复合扩增检测试剂, 其应用6FAM-VIC-NED-PET-LIZ、6FAM-HEX-TMR-ROX-LIZ和6FAM-VIC-NED-TAZ-SID-LIZ等荧光组合进行引物标记[1, 2], 但因检测系统中荧光通道(最多6色)的限制, 相关试剂所能提供的基因座信息数量受到影响, 使这些产品并不能完全满足实际检案的需求。为此, 本研究以GA118-24B遗传分析仪为检测平台, 在前期8色荧光体系研究的基础上[3], 经进一步对荧光能量转移染料的筛选和荧光基团标记方式的优化, 建立了9色荧光分析体系, 为国内外首创。实验验证该体系能显著提高DNA检测数据的信息量。
将每种荧光染料标记而呈现特定颜色的一系列片段峰单独区分出来, 同时消除不同颜色间的干扰峰, 这一处理过程称为光谱分离[4]。STR自动分型技术中, 荧光检测器对多色荧光信号检测记录时, 实际上并不能以单波长进行, 结果就使不同荧光染料之间存在明显的光谱交叉重叠[5]。若大量存在因荧光干扰形成的伪峰, 那么真正的扩增产物片段就将难以正确识别, 导致无法区分等位基因片段。因此, 需要制备荧光校准物, 生成相关于遗传分析仪的正确Matrix文件, 使软件在处理检测信号后, 经计算互相重叠的不同颜色的光谱, 能够使各颜色通道之间互不干扰。
9700型PCR热循环仪(Thermo Fisher公司, 美国); GA118-24B遗传分析仪(公安部第一研究所, 中国); 9色荧光Matrix体系(公安部物证鉴定中心, 中国)。
1)根据遗传分析仪激光器的发射波长和CCD范围, 9色荧光的发射波长范围确定在480~700 nm之间。
2)9种荧光发射光谱能区分开且不相互渗透。
3)9种荧光发射强度尽可能均匀[6]。
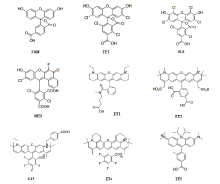
以pUC18质粒为模板, 选取901至1150核苷酸位置, 模板序列见图1, 扩增9个不同大小的片段并用不同荧光标记, 制备Matrix荧光校正品。
根据GenBank® 数据库获取的pUC18碱基序列范围, 使用Primer Express® Software Version 3.0设计引物, 正向引物起点为927核苷酸位置[7], 反向引物根据长度分别设计, 引物序列见表1。委托苏州新海生物技术有限公司合成和荧光标记, 通过PCR扩增制备出标记各色荧光的目的条带。
| 表1 引物序列 Table 1 The sequences of related primers |
荧光校正标准物质中应包含FAM、TET、HEX、NED、ET1、ET2、ET3、ET4和ET5荧光染料标记的DNA片段各一份, 且各片段的分子量大小应有一定的区分度, 荧光染料信息见表2、图2。以pUC18质粒为模板, 选取901至1150核苷酸位置, 扩增9个不同大小的片段并用9色荧光标记, 该9个片段的长度在75~200 bp之间, 临近片段大小相互差异在10~15 bp之间。PCR总体积为20 μ L, 内含2× PCR缓冲液10 μ L, 引物混合物2 μ L, DNA模板1 ng, 纯水补至20 μ L。热循环参数为:95 ℃、11 min; 94 ℃、45 s, 59 ℃、2 min, 72 ℃、1 min, 共28次; 60 ℃ 、30 min。扩增产物4 ℃ 保存。
| 表2 9种荧光染料激发及发射波长范围 Table 2 Exciting and emitting wavelengths of the nine fluorescent dyes |
将扩增获得的9个荧光和长度均不相同的DNA片段纯化后混合备用。用GA118-24B遗传分析仪进行毛细管电泳及数据收集, 按照GA118-24B遗传分析仪操作手册进行光谱矫正。染料集选择“ X9” , 光谱校正标准选择“ MtxStd{GeneScan-SetX9}” 。
取10 μ L Matrix片段混合物与240 μ L去离子甲酰胺混合, 95 ℃、5 min, 冰浴3 min。然后根据电泳结果中各荧光信号的强度, 调整每个片段的混合比例, 将各片段峰高调平。构建的9色荧光分析Matrix文件, 取名为DNATyper9C Matrix, 将文件保存于默认目录。
本研究对目前市面上常用于标记引物的荧光染料进行了分析和筛选, 根据GA118-24B遗传分析仪的激光发射波长及CCD检测范围, 最终确定了FAM、TET、HEX、NED、ET1、ET2、ET3、ET4和ET5 9种荧光染料用于标记引物及内标, 其中后5色荧光染料均应用了荧光能量转移技术。
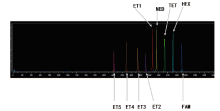
本研究研制的9色荧光标准物所构建的DNATy-per9C Matrix以GA118-24B遗传分析仪电泳, 结果见图3。
在检测设备和条件基本不变的情况下, 不同颜色荧光染料之间的光谱重叠在强度比例上是基本稳定的, 各种荧光染料交叉干扰的程度可以用一个矩阵数值表定量描述。这样一个定量表现荧光片段峰中各种颜色信号强度相对比例关系的数值表, 即为STR荧光标记检测分析技术之Matrix数值表, 由此表构成的相应计算机文件称作Matrix文件。
本研究获得的Matrix数值表见表3。
| 表3 9色荧光Matrix数值表 Table 3 The nine-dye fluorescent matrix and related values |
荧光标记的PCR产物以遗传分析仪检测, 由于不同颜色荧光染料在同一激发波长下其发射波长相互间有干扰, 在邻近色道会出现一个干扰峰(pull-up peak), 为此需要有一个Matrix文件, 以确定主光谱峰, 消除杂色峰。新荧光标记复合扩增体系的开发与应用都需要创建一个新的Matrix光谱校正文件[8], 该Matrix文件的好坏是评估一个多色荧光系统是否能够成功建立的关键指标之一。
理想的荧光染料, 光谱范围应较窄, 每种荧光代表一种引物片段, 检测到某种荧光就意味着检测到某种引物片段, 但实际情况是荧光染料的光谱范围均较宽, 当光谱范围出现重叠的时候, 无法区分哪一部分光谱来自哪种荧光染料, 导致STR片段无法被识别。为解决此问题, 就需要在STR检测之前, 进行光谱校正处理, 建立荧光染料光谱分布矩阵, 对STR数据处理进行实时校正[9]。不同遗传分析仪光谱矫正的数据采集和算法处理不同, 但最终的目的都是为了消除干扰信号, 只保留单一、最强的颜色峰。
荧光共振能量转移(fluorescence resonance energy transfer, FRET)广泛用于生物和化学研究中的荧光增强。当供体荧光团(donor-fluorophore, D-F)的发射波谱与受体荧光团(acceptor-florophore, A-F)的吸收光谱有一定重叠时, 由于远程偶极间的相互作用, 荧光共振能量可以从激发态的D-F通过非辐射过程转移到基态A-F。也就是说, 当D-F的发射波谱与A-F的吸收波谱有一定重叠时, 用D-F的最优激发波长激发D-F, D-F释放的能量会被A-F吸收, 最终得到A-F的发射波长。一个有效的FRET过程, D-F和A-F的距离为10~100 Å , 此外, 光谱重叠度越高, FRET越有效。
本研究9种染料的筛选应满足2个条件:
1)荧光发射能区分开且互不渗透。
2)荧光发射强度均匀。
对于第1个条件, 根据经验和现有试剂盒的波长分析, 荧光能区分开, 需要染料的发射波长间隔至少在20 nm以上, 目前市面上常用于法医检测试剂盒的荧光染料, FAM发射波长最短(520 nm), Cy5发射波长最长(650~660 nm), 要从这两个波长范围中, 再添加7个波长的染料, 势必会出现发射波长间隔不足20 nm、渗透易见的情况, 所以合成新的长波长染料是首要解决的问题。
对于第2个条件, 由于现有的遗传测序仪(ABI 3500/3130或GA118系列), 采用的都是固态激光作为激发光源, 激发波长为488/505 nm的混合激光, 一般的荧光染料没有如此大的斯托克斯位移, 单荧光团标记很难实现检测, 故需要采用FRET标记, 从而使标记的荧光团信号增强, 能实现9种荧光发射信号的均一性。
本研究通过大量实验探索了多种荧光染料组合, 经考虑信号强度、信号均一性, 特别是染料间信号干扰消除以及与现有方法的通用性、延续性等方面的因素后, 最终确定了一套9色荧光染料组合:FAM-190 bp、TET-175 bp、HEX-160 bp、NED-145 bp、ET1-130 bp、ET2-120 bp、ET3-105 bp、ET4-90 bp和ET5-75 bp。
根据实验及验证结果, 总结经验如下:
1)在选择荧光染料前, 务必要先了解所使用仪器激光束激发波长及CCD的检测范围, 以确保荧光染料的激发和发射波长在仪器的检测范围内。
2)另一个需考虑的关键因素是荧光染料的物理和化学性质, 由于荧光染料是疏水性很强的分子, 在亲水溶液中的聚集和碱性溶液中的降解均会影响其检测效率, 而且PCR需要在95 ℃和59 ℃ 之间进行热循环, 因此, 染料稳定性也是一个重要的筛选参数。
3)关于Matrix制备国内外少有报道, Matrix制作主要应关注染料波长和荧光间的相互渗透干扰问题。经对不同厂家的5色/6色试剂盒Matrix测试, 发现片段长度间隔集中在10~30 bp间、不同荧光标记的片段间隔大小及其均匀性对于Matrix文件效果并无太大影响。引物设计的关键在于最大片段不超过200 bp。因为若片段太大, 可能会在仪器程序设定的时间内, Matrix片段出峰不完全, 或者大片段峰型变宽, 从而造成片段分析不准确。因此, 可根据荧光颜色数和实验需要而设计适当大小的Matrix片段引物。
4)当更换缓冲液、毛细管、激光管、荧光检测器等物件时, 应重新建立Matrix文件。
5)9色荧光体系如果标记的是单纯的常染色体STR, 可以组合40~50个基因座, 但若是常+Y模式则可以组合60个以上基因座, 比传统的5色/6色荧光标记要多10~20个以上基因座, 系统效能大幅提升。
本研究为解决国产试剂研发中使用新染料时不同颜色荧光标记的基因座间相互渗透的难题提供了新路径与参考。方法操作简单, 模板易获得, 成功率高, 只需将不同染料标记于对应的引物上进行扩增、纯化和混合调平即可用于遗传分析仪的光谱矫正。本研究是提升国产化DNA检验试剂水平与自主创新能力的一次成功实践。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|