第一作者简介:朱焕慧,男,广东陆丰人,硕士,副高级工程师,研究方向为毒物检验。E-mail: bicop@163.com
目的 建立生物检材中七氟烷(Sevoflurane)及其代谢物六氟异丙醇(Hexafluoroisopropanol, HFIP)的顶空固相微萃取(HS-SPME)-气质联用(GC-MS)检测方法。方法 取1.0mL血液、尿液样本分别置于10mL玻璃进样瓶中,加入1.0mL超纯水、1.0g NaCl混匀,密封,将活化后的50/30μm DVB/CAR-PDMS SPME针插入样品瓶垫内,再50ºC 加热吸附20min用GC-MS(EI)检测。分析测试采用HP-PLOT/Q色谱柱(30m×0.32mm×20μm),质谱采集模式为全扫描模式。结果 生物检材中的七氟烷、HFIP在5~500μg/L范围内,峰面积与浓度呈良好线性关系( R2≥0.996),最低检出限(LOD)均为1.5μg/L,定量限(LOQ)均为5.0μg/L,平均回收率为95%~103%,RSD≤4.3( n=5)。结论 本方法快速、简便、高富集、干扰少,能同时顶空吸附血液、尿液中七氟烷及HFIP并对其进行检测。
Objective To establish a gas chromatography-mass spectrometry (GC-MS) method combining with headspace solid-phase microextraction (HS-SPME) for simultaneous determination of sevoflurane and its metabolite hexafluoroisopropanol (HFIP) in blood and urine.Methods Sampling blood or urine (1.0mL) was added into a 10mL headspace vial, and followed to mix with 1.0mL deionized water and 1.0g NaCl, finally having the vial sealed. The headspace gas was extracted with a SPME fiber (50/30μm DVB/CAR-PDMS) at 50ºC for 20 minutes and successively analyzed into GC-MS (under EI condition) through an HP-PLOT/Q (30m×0.32mm×20μm) capillary column, with the data being acquired under FULL SCAN mode.Results Both sevoflurane and HFIP showed good linear relationship between peak area and concentration within the investigated concentration ranges, with their coefficients of determination being R2≥0.996, their limit of detection (LOD) and limit of quantitation (LOQ) as respective of 1.5μg/L and 5.0μg/L in biological specimens, their average recoveries among 95%-103% and RSD≤4.3% ( n=5).Conclusions The here-developed HS-SPME/GC-MS method is of high speed, simplicity, efficiency, good enrichment and low interference for simultaneous determination of sevoflurane and its metabolite HFIP in blood and urine.
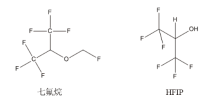
七氟烷又称七氟醚, 即氟甲基-1, 1, 1, 3, 3, 3-六氟异丙基醚, 分子式:C4H3F7O, 为不燃的含氟甲基异丙基醚的衍生物, 常温下为液体, 沸点为58 ℃。七氟烷合成于1968年, 1984年日本购买了七氟烷的专利权并于1990年批准临床使用[1]。目前七氟烷作为医用吸入性麻醉剂被广泛应用于全身麻醉的外科手术 [2, 3]。
七氟烷的主要代谢物为六氟异丙醇(HFIP) 及无机氟化物[4, 5], 七氟烷及HFIP的结构式见图1, 其代谢过程见图2。七氟烷毒性较低, 国内中毒致死案例报道不常见, 国外有相关致死案例报道[6, 7, 8], 在死者体内检出七氟烷, 浓度分别为外周血8 ~ 26 mg/L, 尿液1.1 ~ 105 mg/L, 肝、脑、肾等脏器中高达13 ~ 269 mg/kg。顶空气相色谱(HS-GC)法常用于七氟烷及HFIP的分析检测, 检测器主要使用FID[9]、 MS[10, 11, 12, 13]或ECD [14] 等。目前国内未见将HS-SPME应用于实际刑事案件中七氟烷及HFIP检测的报道。本文利用HS-SPME对挥发性复杂混合物的高富集能力及GC-MS强大定性能力对血液、尿液中的七氟烷及HFIP进行定性定量分析检测, 并对利用七氟烷实施的麻醉抢劫案件中受害者生物样本进行检测, 为案件侦查和定性提供技术支撑。
气质联用仪Thermo GC-MS ISQ QD300 (美国Thermo Fisher公司)。
七氟烷对照品(加拿大Toronto Research Chemicals公司, 98%); HFIP对照品(上海安谱实验科技有限公司, 99.5%); 聚乙二醇400(天津科密欧化学试剂有限公司, 分析纯); 超纯水由Milli-Q 超纯水机(美国Millipore公司)制取。
10 mL玻璃进样瓶, 带铝盖和聚四氟乙烯(PTFE)垫片及配套压盖器。
100 μ m 聚二甲基硅氧烷(PDMS)、65 μ m 聚二甲基硅氧烷-二乙烯基苯(PDMS/DVB)、50/30 μ m 二乙烯基苯/Carboxen-聚二甲基硅氧烷(DVB/CAR- PDMS)固相微萃取头和手动SPME 进样器(美国 Supelco公司)。
1.2.1 固相微萃取条件
新萃取头使用前在250 ℃色谱进样口内活化30 min, 萃取温度:50 ℃; 萃取时间:20 min; 解吸温度:250 ℃; 解吸时间:3 min。
1.2.2 仪器条件
色谱柱类型:HP-PLOT/Q (30 m × 0.320 mm × 20 μ m); 柱温:初始温度60 ℃, 保持1 min, 30 ℃/min升至200 ℃, 保持8 min; 载气:He, 流速:1.3 mL/min , 分流比5:1; 电子轰击(EI)离子源:70 eV; 进样口温度:250 ℃ ; 传输线温度:260 ℃; 离子源温度:280 ℃ ; 溶剂延迟3 min; 全扫描采集模式, 采集范围:m/z 44 ~ 250。
实验得到的GC-MS 总离子流图数据通过NIST谱库数据检索定性。
分别精确称量七氟烷、HFIP标准品适量, 分别用聚乙二醇400、超纯水配制成 1.0 mg/mL 的标准物质储备溶液, 密封, 置于冰箱中冷冻保存备用。七氟烷、HFIP标准曲线系列溶液由储备液现配现用。
取血液或尿液各1.0 mL 分别置于10 mL 玻璃进样瓶中, 加入1.0 mL超纯水和1.0 g NaCl, 用PTFE垫片及铝盖密封、混匀, 置于加热板中50 ℃加热, 用活化后的SPME吸附20 min后插入GC进样口中在250 ℃下解吸3 min, 进行GC-MS分析, 如果检材中七氟烷、HFIP含量较高, 可在检测时将检材按一定量用超纯水稀释, 再进行吸附检测。
2.1.1 配制七氟烷溶剂的选择
在配制系列标准溶液步骤中, 一般选用高沸点的有机溶剂(如乙二醇)来配制水溶性较差的七氟烷 [13]。本实验使用聚乙二醇400配制七氟烷, 它有以下优点:1)使试样更均一稳定地分散在溶剂中。2)聚乙二醇400的蒸气压比乙二醇更低, 在50 ℃加热时更加不易挥发, 不会影响萃取效率, 有利于七氟烷的萃取和识别。样品血液或尿液按照1. 5方法进行测定, 可以充分吸附待测组分, 避免了不同生物基质的干扰, 同时萃取头在250 ℃的温度下待测组分能够完全解吸, 杜绝了对下一针样品的干扰。
2.1.2 SPME萃取头的选择
考察了100 μ m PDMS、65 μ m PDMS/DVB、50/30 μ m DVB/CAR-PDMS三种不同规格萃取头的吸附效果。100 μ m PDMS、65 μ m PDMS/DVB、50/30μ m DVB/CAR-PDMS均能对七氟烷、HFIP进行吸附富集, 实验结果显示, DVB/CAR-PDMS 萃取头得到的HS-SPME/GC-MS的总离子流图中峰面积最大, 说明该萃取头对七氟烷、HFIP有较好的吸附和保留性, 故后续的SPME 分析采用DVB/CAR-PDMS萃取头。
2.1.3 无机盐(NaCl)的优化
加入NaCl会降低目标物在样品瓶液相中的溶解度, 从而使得七氟烷、HFIP更容易从液相中挥发出来, 使固相微萃取头能够吸附更多的七氟烷、HFIP。在萃取温度50 ℃、萃取时间20 min的情况下, 实验考察了在血液样品中加入NaCl的添加量分别为0、0.5、1.0、2.0 g时对萃取结果的影响, 结果发现当加入1.0 g NaCl时, 七氟烷、HFIP的萃取量最高, 加入2.0 g NaCl萃取效率不再明显变化。因此, 确定在样品进行固相微萃取时加入1.0 g NaCl。
2.1.4 顶空进样平衡条件的选取
优化了萃取温度、吸附时间、解吸时间等萃取条件。以各优化项目下检出的七氟烷、HFIP的最大峰面积作为基准计算萃取率, 以萃取率为评价指标, 所得结果见图3。
 | 图3 不同萃取条件对七氟烷、HFIP萃取率的影响Fig.3 Effects of different extraction conditions on the extraction rate of sevoflurane and HFIP |
从图3中可以看出:1)萃取温度逐渐升高, 分析物从体系中挥发出来, 涂层吸附七氟烷、HFIP的萃取率呈现上升趋势。当到达一定温度时, 涂层/样品之间的分配系数也随着温度的增加而减少, 从而降低平衡时的萃取量[15], 所以选择萃取温度为50 ℃。2)随着吸附时间的不断延长, 七氟烷、HFIP的萃取率显著增大, 当达到20 min 后, 峰面积变化不大, 表明七氟烷、HFIP已经达到了吸附和解吸的动态平衡, 因此选择20 min作为最佳吸附时间。3)随着解吸时间的延长, 七氟烷、HFIP的萃取率显著增大, 在3 min 以后, 萃取率的变化趋于平缓。
配制七氟烷、HFIP 系列浓度的空白血添加样品并进样分析。七氟烷、HFIP浓度分别依次为5.0、10.0、50.0、100.0、300.0、500.0 μ g/L。
从表1可知, 本方法对七氟烷、HFIP有良好的线性关系。采用在空白血中添加目标化合物的方法, 依据3倍信噪比确定检出限, 10倍信噪比确定本方法的定量限。
| 表1 方法的线性方程、R2、检出限及定量限 Table 1 The linear equations, correlation coefficients, LODs and LOQs |
使用在空白血液中添加目标化合物的方法测定加标回收率, 评价方法的可靠性。添加七氟烷和HFIP 20、150、400 μ g/L 3个浓度, 每个浓度分别取5份样品进行平行实验, 按照1. 5方法进行测定, 连续测3 d, 按线性方程回归计算其加标回收率、日内和日间精密度。结果见表2。
| 表2 方法的精密度和加标回收率 Table 2 Precisions and standard-spiked recoveries |
资料显示七氟烷的半衰期很短, t1/2为1.8 ~ 3.8 h, 样本送检后需尽快检测, 阳性血液样本在 - 20 ℃下可稳定保存2周至1个月[2]。
按照1.2的仪器条件检测七氟烷、HFIP 的空白血液添加样品, 得到总离子流图(图4)及其分析物对应的质谱图(图5)。本方法有较好分离效果, 峰形尖锐对称。七氟烷、HFIP 的保留时间分别为7.57、13.75 min, HFIP极性较强, 有更长的保留时间。空白血液经萃取后在该色谱质谱条件下不干扰检测。
 | 图4 GC-MS总离子流图(空白血添加1.0 mg/L七氟烷、HFIP)Fig.4 Total ion current spectrum of GC-MS (blood sample added of 1.0 mg/L sevoflurane and HFIP) |
某地区一宗抢劫案受害者的尿液样本, 按本文方法进行处理及检测, 在尿液中检出七氟烷、HFIP成分。
本实验建立了血液及尿液等生物检材中七氟烷、HFIP同步检测的HS-SPME/GC-MS方法。本方法操作简便, 具有高灵敏、干扰小的特点, 可满足涉及此类毒物案件准确定性和定量分析的需要, 为刑事案件调查的定性提供有力的支撑手段。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|