第一作者简介:尚蕾,女,山东临沂人,博士,副主任法医师,研究方向为法医遗传学。E-mail:bluesnoopy9@126.com
目的 建立一套包含迄今所知全部13个快速突变Y-STR基因座的复合扩增检测体系,并对其进行性能验证及法医学应用价值评估。方法 采用五色荧光标记技术,通过引物设计、体系调配,构建出包含13个快速突变Y-STR基因座(DYF387S1、DYF399S1、DYF403S1、DYF404S1、DYS526、DYS449、DYS518、DYS547、DYS570、DYS576、DYS612、DYS626、DYS627)的一套复合扩增体系。根据文献和Sanger法测序,总结了一套快速突变Y-STR基因座的推荐命名方式。对该体系的灵敏度、种属特异性、抗抑制能力等性能及对DNA混合样本的扩增效果进行测试。结果 成功构建了一套快速突变Y-STR检测体系,归纳整理了一套推荐命名方式。经优化,该体系在退火温度为59℃、扩增循环数为28次时扩增效果最佳。体系灵敏度达0.125ng,有良好的种属特异性,对EDTA、血红素、腐殖酸及靛蓝等有较强的抗抑制能力。在高浓度的女性背景下(男女成分比为1∶4000),体系仍能扩增出完整的男性DNA分型。同时,对不同比例的男性DNA混合样本也表现出较好的扩增效果。结论 本文构建的复合扩增检测体系性能良好,可用于男性家系的精细化排查,可作为常见Y-STR检测试剂盒的重要补充。
Objective To establish a novel amplification multiplex of 13 rapidly-mutating (RM) Y-STRs (the known and utilized thus far), and to assess its forensic applicability and capability.Methods A set of new 5-dye Y-STR multiplex system was tentatively developed to amplify 13 RM Y-STR loci (DYF387S1, DYF399S1, DYF403S1, DYF404S1, DYS526, DYS449, DYS518, DYS547, DYS570, DYS576, DYS612, DYS626, DYS627) through optimization of fluorescence labelling, primers designing, constituents concocting and amplification setup. One recommended nomenclature was concluded on the basis of reviewing into peers’ published normalizations and Sanger’s sequencing. The multiplex system was validated with determination of sensitivity, species specificity and stability plus its performance for detecting the mixed DNA samples.Results One novel RM Y-STR amplification multiplex was successfully constructed, demonstrating its optimal annealing temperature of 59°C and cycles of 28. A recommended nomenclature for the RM Y-STR loci was concluded from summarization. Full profiles of the selected Y-STR loci were still obtained down to a low level of template DNA (0.125ng). Besides, the multiplex system was of species-specific and robust to tolerate concentration-high PCR inhibitors (i.e., EDTA, hematin, humic acid and indigo with this assay). Furthermore, the system was able to detect complete male specific genotypic profiles in a male/female DNA mixture at a ratio of 1∶4000, and so was it for male/male ratio-various DNA mixtures to display mutually.Conclusions The RM Y-STR multiplex developed here is of forensic applicability, very suitable for both fine searching into male lineages and complementing to currently-used Y-STR kits.
快速突变Y-STR基因座(rapidly-mutating Y-STRs, RM Y-STRs)自2010年报道以来[1], 获得了国内外的广泛关注。因其突变率较高, 可在常见Y-STR基因座的基础上进一步区分不同的男性个体, 尤其是男性近亲属, 在男性家系排查等方面具有重要的应用价值[2]。目前, 已报道的快速突变Y-STR基因座共有13个, 包括5个多拷贝基因座和8个单拷贝基因座[1]。大量的研究探讨了快速突变Y-STR基因座的突变特征[3, 4, 5, 6, 7], 比较了其与Yfiler Plus、PowerPlex Y23等试剂盒的分辨效能[8, 9, 10]。同时, 一些研究建立了包含快速突变基因座的复合扩增体系。然而, 这些研究所建立的体系仍存在如下不足:1)包含的快速突变基因座数量相对较少[11]; 2)分为2~3个体系进行扩增, 而非在同一体系中扩增全部13个基因座, 扩增效率低[2, 12]; 3)针对DYF403S1基因座的引物设计不完全合理, 可能导致后期分型判断困难[13, 14]; 4)针对DYS526基因座, 只扩增DYS526b而忽略了DYS526a, 人为降低了该基因座的基因多样性水平[15, 16]。此外, 各研究针对具有复杂核心序列的快速突变Y-STR基因座命名方式并不统一。
因此, 本文拟建立一个更全面合理的五色荧光复合扩增体系, 以实现全部13个快速突变Y-STR基因座的有效扩增。同时, 探讨并推荐13个快速突变Y-STR基因座的命名方式, 针对新构建体系开展性能验证, 为其法医学应用奠定基础。
人类基因组标准品(9948、2800M、9947A), 其他生物样本(恒河猴、食蟹猴、马、牛、羊、猫、鼠、兔、鸡、鸭)由中国医学科学院医学实验动物研究所提供并通过其实验动物使用与管理委员会的伦理审查。
本研究构建的体系包含国际报道的13个快速突变Y-STR基因座:DYF387S1、DYF399S1、DYF403S1、DYF404S1、DYS526、DYS449、DYS518、DYS547、DYS570、DYS576、DYS612、DYS626、DYS627[1]。其中, 前5个为多拷贝基因座, 其余8个为单拷贝基因座。
基于五色荧光技术, 根据各基因座核心重复区的特点, 将上述基因座均匀排布于80~460 bp的区间内。利用Primer v.5.0软件进行基因座的引物设计, 各基因座的正向或反向引物分别标记蓝色(FAM)、绿色(HEX)、黄色(TAMRA)或红色(ROX)荧光基团。内标则以橙色(LIZ)标记。
国内外当前对快速突变Y-STR基因座命名方式尚不统一, 通过检索文献、基因座扩增测序验证等方法进行综合研究, 探求较合理的等位基因命名方式。
首先, 针对单个基因座进行扩增, 以检验引物设计的特异性。扩增选用10 μ L体系:5 μ L 2× Master Mix (公安部物证鉴定中心), 各1 μ L 上、下游引物(终浓度均为1 μ mol/L), 3 μ L 1× TE, 以及1 ng 模板DNA。然后, 将全部13个基因座复合到一个体系中进行扩增, 选用10 μ L体系:5 μ L 2× Master Mix, 5 μ L引物混合液, 1 ng模板DNA。PCR扩增程序:95 ℃预变性11 min; 94 ℃变性30 s, 59 ℃退火2 min, 72 ℃延伸1 min, 循环28次; 60 ℃延伸1 h。
检测时, 取1 μ L PCR扩增产物, 加入10 μ L去离子甲酰胺和0.15 μ L内标(Typer500, 公安部物证鉴定中心)的混合物中, 于3500 XL型遗传分析仪进行毛细管电泳, 对上述Y-STR基因座进行荧光检测。所得检测数据以Genemapper ID-X v.1.5进行分析, 设置50 RFU的检测阈值。
为验证个别基因座(DYS612、DYS626、DYS547)的核心重复序列, 在进行单基因座扩增后, 取扩增产物进行Sanger法测序(生工生物, 上海), 并利用MEGA v.7.0.26软件分析测序文件。
设置不同的退火温度(55、57、59、61、63 ℃)、不同的PCR循环数(24、26、28、30、32)、不同的体系体积(5、10、20 μ L), 探讨退火温度、PCR循环数、体系体积变化对扩增效果的影响。扩增模板为1 ng 男性基因组标准品9948。
利用荧光标记的单基因座引物扩增各基因座的等位基因重组质粒, 以一定比例进行混合, 获得本研究体系的等位基因分型标准物。
1.7.1 灵敏度
体系中DNA(男性基因组标准品9948)模板量分别设置为2.0、1.0、0.5、0.25、0.125、0.062 5、0.031 25ng, 研究体系获得完整分型的最小模板量。
1.7.2 种属特异性
检测哺乳类动物(恒河猴、食蟹猴、马、牛、羊、猫、鼠、兔)和非哺乳类动物(鸡、鸭)等的DNA 样品, 以确定体系是否具有良好的种属特异性。
1.7.3 稳定性
选择EDTA、血红素(hematin, HE)、腐殖酸(humic acid, HA)、靛蓝等常见的抑制剂进行体系稳定性的检验。其中, EDTA的浓度梯度设置为:0. 25、0.5、0.75、1.0 mmol/L; 血红素的浓度梯度设置为1.5、1.75、2.0、2.25 mmol/L; 腐殖酸的浓度梯度设置为50、100、150、200 ng/μ L; 靛蓝的浓度梯度设置为2.0、3.0、4.0、5.0 mmol/L。各浓度梯度设置3~4 次重复。扩增模板为1 ng男性基因组标准品9948。
1.7.4 混合样本
取不同的男性DNA标准品(9948、2800M)分别以1∶ 19、1∶ 9、1∶ 3、1∶ 1、3∶ 1、9∶ 1、19∶ 1 的浓度比例混合, 取混合物1 ng加入体系中扩增并进行分型检测, 每个比例设置3 次重复。取男性DNA标准品(9948)和女性标准品(9947A)分别以1∶ 1 000、1∶ 2 000、1∶ 4 000的比例混合加入体系中进行扩增检测, 体系中9947A的加入量为500 ng, 9948的加入量分别为0.5、0.25、0.125 ng, 设置3次重复。
快速突变Y-STR复合扩增体系(RM Y-STR体系)的基因座排布如图1所示。基因座DYS526由于两个拷贝的扩增产物大小不同, 占据了panel中的两个不同位置。基因座DYF403S1占据了panel中的三个不同位置, 这与其不同拷贝及其核心重复区结构有关。
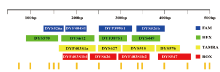 | 图1 快速突变Y-STR复合扩增体系的基因座排布Fig.1 The multiplex system plus its enclosing fluorescent-dye-expressed rapidly-mutating Y-STR loci and their size ranges |
经Sanger法测序, 进一步验证了DYS612、DYS626等基因座的核心重复序列, 同时发现, DYS547的核心重复序列为(CCTT)nT(CTTC)mN54(TTTC)pN10 (CCTT)4(TCTC)1(TTTC)q, 与部分文献报道的不同。结合测序结果和文献查阅, 建议各基因座的等位基因命名方式及相应标准品(9948、2800M)分型结果见表1。
| 表1 快速突变Y-STR基因座的核心重复序列及推荐命名方式(参考文献[10], [12], [17]) Table 1 Core repetitive sequences and recommended nomenclature of rapidly-mutating Y-STR loci (citations[10], [12], [17]) |
2.2.1 退火温度
利用不同退火温度进行体系扩增, 结果显示, 当退火温度较低(55 ℃)时, 容易出现非特异性扩增, 产生较多杂带, 而当退火温度为63 ℃时, 则会出现部分等位基因丢失(图2)。比较其他3个退火温度的扩增结果可见, 当退火温度为59 ℃时获得的图谱扩增的特异性和均衡性最佳。
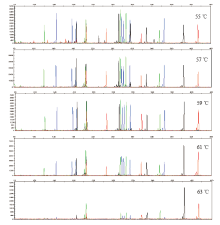 | 图2 不同退火温度对体系扩增男性基因组标准品(9948)影响Fig.2 Electrophoretograms revealing the influence of various annealing temperatures on the multiplex system to amplify male DNA (9948) |
2.2.2 扩增循环数
采用不同扩增循环数进行体系扩增, 结果显示, 在不同扩增循环次数下均未出现等位基因丢失的情况。但随着PCR扩增循环次数增加, 检测得到的荧光峰高逐渐增加(图3)。循环数少(24或26), 基因座整体的扩增效率相对较低。循环数多(32), 短小片段的扩增优势明显, 影响体系扩增的均衡性。
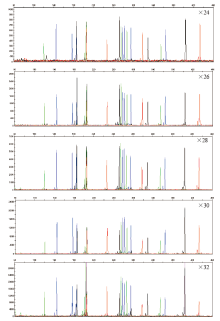 | 图3 不同循环数对体系扩增男性基因组标准品(9948)的影响Fig.3 Electrophoretograms showing the influence of different cycles on the multiplex system to amplify male DNA (9948) |
通常情况下, 建议采用28次循环进行扩增, 而在样本质量较差时, 可增加循环数至30次, 以获得更佳的扩增结果。
2.2.3 反应体积
不同反应体积的扩增结果如图4所示。发现采用不同的反应体积扩增均未出现等位基因丢失的现象, 表明反应体积不会影响基因座扩增的完整性, 同时, 对扩增后各基因座的均衡性也无明显影响。
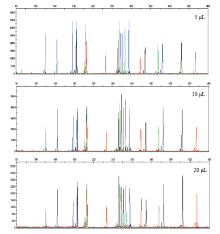 | 图4 不同反应体积对体系扩增男性基因组标准品(9948)影响Fig.4 Electrophoretograms demonstrating less influence of discrepant reaction volumes on the multiplex system to amplify male DNA (9948) |
在添加模板量相同的情况下, 较小体积的反应体系在扩增后呈现出较高的荧光检测峰高, 反之亦然。实际应用可依据实际情况选择扩增反应体系的体积。
快速突变Y-STR复合扩增体系的等位基因分型标准物如图5所示。
 | 图5 快速突变Y-STR复合扩增体系的等位基因分型标准物Fig.5 The allelic ladder of the rapidly-mutating Y-STR multiplex exhibited with electrophoretogram |
由图可见, 各基因座的等位基因无交叉重叠, 峰形尖锐, 有助于获得明确、清晰的Y-STR分型结果。同时, 各基因座的等位基因均已测序确认。
2.4.1 灵敏度
由图6可见, 当模板量≥ 0.125 ng时, 全部基因座的所有等位基因均可实现正常分型, 而当模板量< 0.125 ng时, 部分等位基因出现丢峰现象, 表明快速突变Y-STR扩增体系具有较高的检测灵敏度。
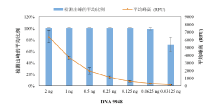 | 图6 体系的灵敏度检测结果 (误差线表示标准误)Fig.6 Sensitivity (detection limit) of the RM Y-STR multiplex (Error bars represent the standard errors) |
2.4.2 种属特异性
对所选哺乳类动物(恒河猴、食蟹猴、马、牛、羊、猫、鼠、兔)的DNA进行扩增检验分析, 均未获得扩增条带。同时, 对人类经常接触的非哺乳类动物(鸡、鸭)的DNA进行检测, 也未发现扩增条带。表明快速突变Y-STR扩增体系具有较好的种属特异性。
2.4.3 稳定性
当加入终浓度为0.5 mmol/L的EDTA、1.5 mmol/L的血红素或4 mmol/L的靛蓝时, 各基因座均未出现丢带现象。随着体系中EDTA、血红素或靛蓝的浓度继续增加, 基因座扩增受到抑制, 检测峰丢失(图7)。在体系中加入50 ng/μ L的腐殖酸, 体系会偶发丢带现象, 随着腐殖酸浓度的增加, 丢带现象愈加明显。
 | 图7 体系的稳定性测试结果 (误差线表示标准误)Fig.7 Stability of the RM Y-STR multiplex tested with EDTA, hematin, humic acid and indigo (Error bars represent the standard errors) |
2.4.4 混合样本
在高浓度的女性背景下(男性成分与女性成分之比为1∶ 1000~1∶ 4000), 所构建的RM Y-STR体系均能获得完整的Y-STR分型(图8)。但在DYS627和DYS518基因座之间出现了非特异性扩增峰, 并渗透到其他荧光色。
经后期实验验证, 在扩增不同高浓度样本(包括男性样本和女性样本)时可能会在同一位置出现该非特异性峰, 对男性样本分型的判断影响不大, 但在数据分析时应加以注意。
针对不同比例的9948/2800M混合样本, 所构建RM Y-STR体系均可以获得两者的完整分型, 如图9所示。在实验设置的混合比例下, 混合样本中次成分DNA的Y-STR分型检出比例均为100%。
目前国内外针对快速突变Y-STR基因座的命名方式尚不统一, 这可能会影响该类基因座或试剂盒在案件排查等方面的应用。结合已有资料和实验验证, 本研究整理出了推荐命名方式, 该命名方式符合ISFG针对Y-STR基因座提出的命名规则[18], 同时与Zhang等[17]在2016年提出的命名方式完全相同, 但与其他研究报道的命名方式存在差异[10, 14, 19, 20, 21]。尤其DYS547基因座, 其核心重复序列存在两个碱基的差异。本研究获得的序列与Zhang等[17]获得的序列一致, 为(CCTT)nT(CTTC)mN54(TTTC)pN10(CCTT)4(TCTC)1(TTTC)q, 而UCSC网站(genome.ucsc.edu)及其他研究报道的序列则为(CCTT)nT(CTTC)mN56(TTTC)pN10(CCTT)4(TCTC)1(TTTC)q。这或许与不同人群的序列差异有关。综上, 建议尽快推出关于此类基因座的等位基因命名标准, 统一命名规则, 为后期应用提供重要参照。
与国内外已建立的同类体系相比, 本研究建立的RM Y-STR体系在多方面有所改进。首先, 在一个体系中可以同时扩增全部13个快速突变基因座。其次, 针对特殊基因座, 可实现多个拷贝的分别扩增。如DYF403S1基因座含有4个拷贝, 其中3个拷贝的核心序列结构十分相似, 可缩写为(TTCT)nN2-3(TTCT)p。参照Lee等[12]提出的方法改进引物后, 可将含有不同核心序列结构的拷贝分开扩增, 从而使分型判定更加准确。再如DYS526基因座, 通过引物设计可分别扩增出DYS526a和DYS526b两个拷贝, 能获得该基因座更多的遗传信息。再次, 体系的全部基因座在4种荧光标记、80~460 bp的区间内均匀排布, 更具实用性。
经测试, 本研究构建的体系具有较好的灵敏度、种属特异性和稳定性。灵敏度方面, RM Y-STR体系可达0.125 ng, 与Yfiler、Yfiler Plus等试剂盒的灵敏度相当[22, 23], 而略低于PowerPlex Y23试剂盒的灵敏度[24]。稳定性方面, RM Y-STR体系可耐受1.5 mmol/L血红素, 高于Yfiler、Yfiler Plus、Power-Plex Y23等试剂盒已报道的可耐受浓度[22, 23, 24]; 该体系基本可耐受50 ng/μ L的腐殖酸, 比Yfiler Plus和PowerPlex Y23等试剂盒的稳定性略差[23, 24], 与DNATyperY26的结果相近[25]。究其原因, RM Y-STR体系中包含5个多拷贝基因座, 这些基因座在Y染色体上拥有不少于2个拷贝, 意味着在扩增时同一对引物需要同时结合在染色体2~4处不同位置上, 扩增难度更大。此外, 扩增缓冲液也可能对体系的稳定性造成影响。
RM Y-STR体系对混合样本具有较好的扩增效果。在实验设置的混合比例下, 均未出现次成分丢峰的情况。本体系对男性与女性混合样本的扩增性能可达到或高于Yfiler Plus、PowerPlex Y23、DNATyperY26等试剂盒[23, 24, 25]; 对男性混合样本的扩增性能与Yfiler相当[24], 略高于上述三种试剂盒[23, 24, 25]。扩增性能的提升, 一方面与使用的扩增缓冲液有关, 另一方面, 可能受到体系所含基因座拷贝数的影响。体系中含有的基因座拷贝数越多, 在模板量较低时获得完整分型的难度越大。
RM Y-STR体系与Yfiler Plus试剂盒或DNATyperY36试剂盒联用, 可以增加7个基因座(14个基因座拷贝)的检测结果, 与PowerPlex Y23试剂盒联用, 可以增加11个基因座(19个基因座拷贝)的检测结果。RM Y-STR复合扩增体系有望成为既有主流Y-STR试剂盒的重要补充, 辅助男性家系的精细化排查, 为案件侦办提供更多线索。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|




