第一作者简介:蔡玉刚,男,四川遂宁人,学士,高级工程师,研究方向为理化检验。E-mail: 12721703@qq.com
目的 研究氟阿普唑仑及其主要代谢物α-羟基氟阿普唑仑在大鼠体内分布及代谢规律。方法 40只SD 大鼠随机分为4组,禁食12h,第一组按0.45mg/kg 氟阿普唑仑灌胃给药后不同时间点采集大鼠尾静脉血,并收集每天尿液;第二组为血液实验空白对照组;第三组给药0.25h后处死,取血、心、肝、肺、肾、脑、脾、肌肉,经快速溶剂萃取提取后用高效液相色谱-三重四极杆质谱检测氟阿普唑仑及α-羟基氟阿普唑仑含量;第四组为分布实验空白对照组。结果 氟阿普唑仑进入体内后,迅速分布代谢,在0.25h内达到血液最高浓度。氟阿普唑仑在各器官中的分布特点为:肾>脑>心>肝>肌肉>脾>肺>血,α-羟基氟阿普唑的分布特点为:肝>肾>心>脾>肺>肌肉>血>脑。结论 本研究监测了氟阿普唑仑及主要代谢物在大鼠体内的分布及降解规律,为氟阿普唑仑的体内检验及体内过程分析提供科学依据。
Objective To probe into the distribution and metabolic pathway of flualprazolam plus its main metabolite (α - hydroxylflualprazolam) in rat.Methods 40 SD rats were randomly divided into 4 groups and fasted for 12 hours, with the first group being fed of flualprazolam by gavage as per 0.45 mg/kg and having their respective blood collected from tail vein at different time and each one's urine received every day after administration. The second group was taken as the blank control to the first one. The third group was executed at 0.25h after drug administration, having their respective blood, heart, liver, lung, kidney, brain, spleen and muscle collected and extracted with rapid solvent extraction. The fourth group was the blank control against the third one. The distributing and metabolizing flualprazolam and α - hydroxyflualprazolam were detected through HPLC-MS/MS.Results Flualprazolam was found of rapid distributing and metabolizing in rats, reaching its highest blood concentration within 0.25h, having shown its sequential distribution in various organs as follows: kidney > brain > heart > liver > spleen > muscle > muscle > lung > blood. Yet, α - hydroxyflualprazolam demonstrated its discrepant organ-specific distributing order: liver > kidney > heart > spleen > lung > muscle > blood > brain.Conclusion The experiment has showed the distribution and degradation of flualprazolam and its main metabolite in rats who were administered of flualprazolam by gavage, capable of providing scientific basis for flualprazolam to test in vivo and have its metabolic pathway analyzed.
氟阿普唑仑(flualprazolam)是一种设计型含有三环结构的三氮唑苯二氮䓬类精神药物, 目前尚未被临床使用。由于该药物与阿普唑仑和三唑仑作用相似, 在剂量较低的情况下有较好的麻醉作用, 且未被列入国家管控目录, 被不法分子在网络上公开售卖, 常被用于麻醉强奸、麻醉抢劫, 少量见于药物依赖和自杀。氟阿普唑仑进入体内后被迅速吸收并分布于各组织, 在体内主要通过羟基化代谢为α -羟基氟阿普唑仑和4-羟基氟阿普唑仑两种具有活性代谢物, 进一步与葡萄糖苷酸结合排出体外[1]。
目前, 对氟阿普唑仑报道[2, 3, 4, 5, 6, 7]仅有案例、少量结构确证的数据和检验方法, 对其组织分布和代谢降解规律未见报道。因此, 本文研究大鼠经灌胃给药后, 氟阿普唑仑及主要代谢物α -羟基氟阿普唑仑在大鼠体内各组织分布情况, 并对血、尿中的药物浓度进行实时监控, 为进一步揭示氟阿普唑仑在体内的分布及降解规律提供理论依据。
仪器:Agilent 6470高效液相色谱-三重四极杆质谱仪(美国Agilent公司); AL204-IC型分析天平(瑞士Metlle Toledo公司); Milli-Q Direct 8超纯水机(美国Millipore公司); Dionex ASE350型快速溶剂萃取仪(美国 Thermo Fisher Scientific公司); CV600冷冻真空浓缩仪(北京吉艾姆公司)。
试剂:氟阿普唑仑(≥ 98%, 中科院上海有机化学研究所), α -羟基氟阿普唑仑(1 mg/mL, sigma-aldrich, 美国), 乙酸乙酯、甲醇、乙腈(色谱纯, Fisher, 美国), 甲酸(色谱纯, Merck, 德国)。
1.2.1 色谱条件
色谱柱:Luna Omega C18 (50 mm × 2.1 mm, 1.6 μ m); 流动相:A相, 0.1%甲酸-水溶液; B相, 乙腈。柱温:35 ℃; 流速:0.4 mL/min; 进样量:1 μ L; 梯度洗脱条件:B相初始浓度为20%, 4 min内由20%增加到30%, 到8 min由30%增加到95% , 到10 min由95%变为20%, 样品检验过程用时10 min。
1.2.2 质谱条件
离子源:电喷雾离子源(ESI), 正离子扫描; 干燥气温度:325 ℃; 干燥气流速:10 mL/min; 雾化器压力:45 psi; 屏蔽气:氮气, 气体温度400 ℃, 流量12 mL/min; 毛细管电压:4 000 V。检测方式:多反应监测(MRM)扫描。氟阿普唑仑及代谢物MRM离子及碰撞能见表1。
| 表1 氟阿普唑仑及代谢物保留时间、MRM离子及碰撞能(CE) Table 1 Retention time and MRM conditions for flualprazolam and its metabolite |
1.3.1 血液样品前处理
取待测血液0.2 mL, 加入乙酸乙酯1.0 mL, 涡旋振荡5 min, 超声萃取10 min, 10 000 r/min离心5 min, 重复提取两次, 合并有机相, 50 ℃氮吹浓缩挥干, 加入200 μ L甲醇涡旋振荡溶解, 过0.22 μ m滤膜, 待检。
1.3.2 组织样品前处理
取待测组织0.5 g匀浆后放于研钵中[6, 7], 加入1.0 g硅藻土混匀研磨至颗粒状, 装入5.0 mL的萃取池中, 在萃取柱温80 ℃、柱压1.034× 104 kPa、静态萃取5 min条件下, 用乙酸乙酯:氨水(97:3, 体积比)3.0 mL作为冲洗剂, 用快速溶剂萃取提取两次, 合并冲洗液至10 mL离心管中, 置于30 ℃冷冻真空浓缩仪(600 r/min)浓缩至1.0 mL左右后, 加入1 mL甲醇, 涡旋振荡混匀1 min, 将液体转移至2 mL进样瓶中, 然后置于50 ℃冷冻真空浓缩仪(300 r/min)上吹干, 用200 μ L甲醇涡旋振荡溶解, 过0.22 μ m滤膜, 待检。
1.3.3 尿液样品前处理
取尿液1.0 mL, 加入2.0 mL乙腈, 涡旋振荡5 min, 10 000 r/min离心5 min, 取上清液, 过0.22 μ m滤膜, 待检。
取空白全血0.2 mL, 以及各匀浆组织0.5 g, 分别添加氟阿普唑仑和α -羟基氟阿普唑仑, 均配成0.02、0.05、0.1、0.2、0.5、1.0 ng/mL(ng/g)空白添加样, 按照1.3.1、1.3.2中的方法进行提取后检测; 取空白尿液1.0 mL, 分别添加氟阿普唑仑和α -羟基氟阿普唑仑均配成0.06、0.15、0.3、0.6、1.5、3 ng/mL空白添加样, 按照1.3.3中的方法提取后检测, 以待测物浓度为横坐标, 待测物峰面积为纵坐标, 分别建立血液、组织和尿液标准曲线, 并分别得出标准曲线方程及相关系数。
40只雄性SD大鼠(由西南医科大学动物实验中心提供)随机分为四组, 体重200 g± 10 g, 每组10只, 禁食12 h后, 第一组一次性灌胃给药0.45 mg/kg(参照阿普唑仑临床上成年人每日最大剂量5 mg/d经体表面积换算后剂量)的氟阿普唑仑, 分别在0.25、0.5、1、1.5、2、3、4、5、7、10、12、24、36、48、72、96、120、144、168、192、216 h经大鼠尾静脉采血0.2 mL; 第二组作为血液空白对照组与第一组相同时间取血0.2 mL, 同时收集第一组和第二组每12 h的尿液; 第三组一次性灌胃给药0.45 mg/kg的氟阿普唑仑0.25 h(预实验血液平均浓度最高)后立即处死, 第四组作为内脏空白组与第三组同时处死, 立即解剖取脑、心、肝、肺、肾、脾、血液、肌肉, 按照1.3.2方法进行样品处理, 并按照1.2实验条件进行检验。
以上动物实验已通过西南医科大学实验动物伦理委员会审查。
数据用SPSS16.0进行统计分析。
在考察了SB C18 Aq、Eclipse Plus C18、Luna OmegaC18三种C18色谱柱, 合适的流动相及合适的梯度洗脱后得到的1.2.1的色谱条件下, 样品中氟阿普唑仑、α -羟基氟阿普唑仑的保留时间分别为:7.207和6.904 min, 空白添加1 ng/mL标样的保留时间分别为:7.221和6.922 min。以空白血液添加标样(图1)、肝组织色谱图(图2)为例, 组分分离较好, 色谱峰峰形较好。
 | 图1 空白血液添加氟阿普唑仑及代谢物色谱图Fig.1 Chromatograms of flualprazolam and its metabolite spiked into blank blood |
样品中氟阿普唑仑和α -羟基氟阿普唑仑在0.02 ~1.0 ng/mL(ng/g)之间相关系数均在0.993 5以上, 线性良好。线性方程、相关系数及最低检出限见表2。
| 表2 氟阿普唑仑及代谢物在各组织中线性方程、线性范围、最低定量限及最低检出限 Table 2 Linear equations, linear ranges and LOQs and LODs of flualprazolam and its metabolite |
实验表明, 血液中氟阿普唑仑和α -羟基氟阿普唑仑在0.05、0.5、1.0 ng/mL三个浓度下的日内和日间(48 h)精密度良好, 回收率高(见表3)。
| 表3 血液中氟阿普唑仑及代谢物的回收率及精密度(n=5) Table 3 Recovery and precision of flualprazolam and its metabolite in blood samples |
2.4.1 血液中氟阿普唑仑及代谢物的降解规律
实验数据表明, 氟阿普唑仑灌胃进入大鼠体内后, 血液中的氟阿普唑仑在0.25 h内达到最大浓度并迅速代谢为α -羟基氟阿普唑仑, 随后逐渐衰减, 在3 h左右血液浓度出现与0.25 h时浓度相当的峰值, 随后逐渐减少, 在36 h时出现相当于最高浓度76.3%的峰值, 然后逐渐减少。α -羟基氟阿普唑仑在0.25 h内达到最大浓度, 随后逐渐衰减, 在3 h左右出现一个相当于0.25 h浓度30.6%的峰值, 在36 h出现一个相当于最大浓度3%左右的峰值, 随后逐渐减少(图3a)。
 | 图3 氟阿普唑仑及代谢物在血液(a)、尿液(b)中的含量变化Fig.3 Changing flualprazolam and its metabolite in blood (a) and urine (b) |
2.4.2 尿液中氟阿普唑仑及代谢物的降解规律
实验表明, 氟阿普唑仑灌胃进入大鼠体内后, 尿液中氟阿普唑仑和α -羟基氟阿普唑仑在12~16 h之间含量最高, 随后在逐渐减少, 在216 h时均能检出氟阿普唑仑和α -羟基氟阿普唑仑(图3b)。
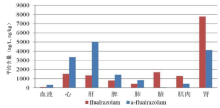
实验数据表明, 氟阿普唑仑进入大鼠体内0.25 h后, 氟阿普唑仑和α -羟基氟阿普唑仑血液浓度达到最高值, 并迅速分布各个组织。其具体分布情况见表4和图4。
| 表4 氟阿普唑仑及代谢物在大鼠组织中的含量分布 Table 4 Distribution of flualprazolam and its metabolite in rat tissues |
氟阿普唑仑及其主要具有活性的代谢物α -羟基氟阿普唑仑均系三氮唑苯二氮䓬类精神类药物[8, 9], 进入体内后与人体中枢苯二氮䓬受体结合而促进γ -氨基丁酸(GABA)的释放或突触传递功能, 当GABA受体激动时, Cl-通道开放的数目增多, Cl-进入细胞内数量增加, 产生超极化而引起抑制性突触后电位, 减少中枢内某些重要神经元的放电, 引起中枢神经系统的抑制作用。与大多数苯二氮䓬药物中毒症状一样, 少量摄入表现为嗜睡、共济失调, 大剂量时可导致昏迷、血压下降、呼吸循环抑制、心跳停止。由于氟阿普唑仑未被临床使用, 其用量参数在国内外文献未见报道, 本实验氟阿普唑仑给药量参考阿普唑仑成人临床剂量, 经体表面积换算公式换算, 以灌胃的形式进行。预实验中以0.45 mg/kg的剂量给大鼠灌胃后, 大鼠出现步态蹒跚、刺激性反射、烦躁性尖叫, 36 h内排尿量明显减少, 部分出现无尿现象。文献报道[10], 阿普唑仑在给药后1~2 h达到血液最高浓度, 而氟阿普唑仑2位有F-取代, 较阿普唑仑与机体结合更快, 作用更强。
实验数据表明, 氟阿普唑仑进入大鼠体内0.25 h内达到血液最高浓度, 代谢物α -羟基氟阿普唑仑在0.25 h以内亦达到最高浓度, 经预实验对不同时间点处死的大鼠进行的体内药物浓度检测, 确定0.25 h为大鼠处死时间。
根据实验结果, 10只大鼠经灌胃给药氟阿普唑仑后0.25 h, 血液中氟阿普唑仑及其代谢物α -羟基氟阿普唑仑均达到峰值。给药8 h后, 血液中的氟阿普唑仑含量至峰值的0.0%~12.9%, α -羟基氟阿普唑仑含量至峰值0.0%~4.9%, 12 h后部分时间点低于检出限, 在10 d监测中, 大鼠的血液中均能检出氟阿普唑仑和α -羟基氟阿普唑仑。氟阿普唑仑和α -羟基氟阿普唑仑的血液含量在灌胃给药3、36 h左右分别出现一个降低后的峰值。二次峰值出现的代谢规律是否是药物摄入方式所导致还是其他原因有待进一步研究。
实验结果表明, 血液中除α -羟基氟阿普唑仑和4-羟基氟阿普唑仑外, 还存在去甲氟阿普唑仑和去甲羟基氟阿普唑仑, 这两种代谢物是否具有活性也待下一步研究。
氟阿普唑仑常被用于麻醉抢劫和麻醉强奸, 出现致死情况较少, 受害者报案时间距案发时间较长, 能得到的体内检材常为血液和尿液, 本文对尿液中氟阿普唑仑及代谢物进行了监测, 实验结果表明, 氟阿普唑仑和α -羟基氟阿普唑仑在给药后12~16 h之间的尿液浓度出现峰值, 随后就逐渐减少, 由于给药后大鼠出现少尿或无尿的情况, 取尿时间间隔较长, 未见二次峰值的情况。
实验结果表明, 氟阿普唑仑在各组织中含量分布特点为:肾> 脑> 心> 肝> 肌肉> 脾> 肺> 血; α -羟基氟阿普唑仑在各组织中含量分布特点为:肝> 肾> 心> 脾> 肺> 肌肉> 血> 脑。在给药0.25 h后, 氟阿普唑仑很快分布于各个器官, 且含量较高, 说明氟阿普唑仑有较高的亲脂性。
实验表明, 氟阿普唑仑在肾中的含量明显高于其他器官且α -羟基氟阿普唑仑在肾中也有较高含量, 说明氟阿普唑仑经肾排出体外较快; 其次氟阿普唑仑在脑组织含量仅次于肾, 而α -羟基阿普唑仑在脑组织中含量最少(几乎没有), 说明氟阿普唑仑进入血液后很快透过血脑屏障作用于大脑; α -羟基氟阿普唑仑在肝中含量最高, 说明氟阿普唑仑主要在肝中代谢, 据文献报道[11, 12], 三氮唑苯二氮䓬类药物, 一般经肝脏CYP3A酶系代谢为活性物质α -羟基三唑安定。实验表明, 血液、心、肝、脾、肺组织中α -羟基氟阿普唑仑的含量高于氟阿普唑仑的含量, 脑、肌肉、肾组织中氟阿普唑仑含量高于α -羟基氟阿普唑仑。氟阿普唑仑的代谢过程, 有待下一步动态检测研究。
本文以高效液相色谱-三重四极杆质谱方法对建立的药用量氟阿普唑仑动物模型中氟阿普唑仑及代谢物在体内分布情况进行测定, 并对氟阿普唑仑及代谢物在血液中的降解规律进行了监测, 获得了相关的毒理学和代谢降解规律数据, 为相关案件的检材采集、处理、检验提供了相关的科学依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|