第一作者简介:乔静,女,北京人,硕士,高级工程师,研究方向为毒物分析。E-mail: smhsool@sina.com
目的 建立血液中草铵膦的衍生化气相色谱-质谱(GC-MS)检测方法。方法 在空白血液中添加标准草铵膦,甲醇/乙腈(2:8,体积比)提取,提取液挥干后甲醇复溶,加入等量乙酸酐在80℃干燥箱中衍生化1h, 衍生产物于蒸发皿中80℃水浴挥干,用0.2mL乙腈定容后GC-MS分析。结果 该方法血液中草铵膦乙酸酐衍生化的最小检出限为0.2µg/mL(S/N=45:1),在0.5 ~10µg/mL范围内线性良好,外标法工作曲线为 y=324826 x+30384, R2=0.9975,RSD%( n=3)为3.2%。结论 该方法简便、可靠、易普及,适用于刑事案件中草铵膦的检验。
Objective To establish a method for detecting blood-harbored glufosinate ammonium through derivatization to undergo into GC/MS analysis.Methods Glufosinate ammonium was extracted from whole blood with methyl alcohol/acetonitrile (2/8, V/V), successively subjected to evaporation at water bath of 80°C, consecutively having its residues resolved into methyl alcohol with which the same amount of acetic anhydride was followed to add for derivatization to perform under the time and temperature respective of 1h and 80°C. Finally, the derivatized product was dried and then resolved with acetonitrile (0.2mL) for detection of GC/MS along with external standard.Results With derivatization of acetic anhydride, the tested glufosinate ammonium got its correlation coefficient about 0.993 from the linear curve within concentrations ranging among 0.5~10µg/mL, having the relative standard deviation of 3.2% ( n=3) and limit of qualification of 0.2µg/mL (S/N = 45/1).Conclusion The method is simple and reliable for qualitative and quantitative analysis of glufosinate ammonium in whole blood.
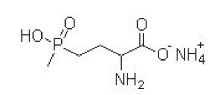
草铵膦(glufosinate ammonium)又名草胺磷铵盐、草丁膦, 商品名为保试达(basta)、百速顿, 化学名为4-[羟基(甲基)膦酰基]-DL-高丙氨酸或2-氨基-4-[羟基(甲基)膦酰基]丁酸铵(2-amino-4-(hydroxymethylphosphinyl)butyric acid ammonium salt), 结构式见图1[1]。草铵膦为白色结晶, 有轻微气味, 熔点为210 ℃, 760 mm Hg下沸点为519.1 ℃。草铵膦在常见有机溶剂中溶解度较低, 在水中溶解度较大。pH 5~9时水解, 对光稳定。分子式:C5H15N2O4P, 相对分子质量198.157 4。
草铵膦属于膦酸类除草剂, 能够抑制植物氮代谢途径中的谷氨酰胺合成酶, 从而干扰植物的代谢, 使植物死亡[2]。草铵膦具有杀草谱广、低毒、活性高和环境相容性好等特点, 其发挥活性作用的速度比百草枯慢而优于草甘膦, 成为与草甘膦和百草枯并存的非选择性除草剂, 应用前景广阔。许多杂草对草铵膦敏感, 在对草甘膦产生抗性的地区可以作为草甘膦的替代品使用[3]。
目前, 国内外文献报道草铵膦的检测方法有高效液相色谱(HPLC)法[4]、液相色谱-串联质谱(LC-MS)法[5, 6, 7]、离子色谱法[8, 9]、毛细管电泳法[10]、毛细管电泳法-质谱法[11], 其中以LC-MS法检测为主。由于草铵膦为水溶性化合物, 提取方法有水相提取、有机相或固相净化去油脂法[4, 5, 6, 8, 12, 13]和固相萃取法[10, 11, 12, 13, 14]。若使用衍生化方法, 最常用的衍生化试剂为硼酸钠缓冲液和FMOC-CL丙酮溶液[4, 5]、三氟乙酸酐[12, 13, 14]、丙酸酐[15]。目前文献中报道的草铵膦检测方法大多是针对农残的检测[4, 5, 6, 7, 8, 10, 12, 13, 14], 王勇等[7]建立了血液中草铵膦的离子色谱检测方法, 血中草铵膦的检测限为1.9 mg/L, 定量限为6.0 mg/L, 回收率在69.7%~89.2%之间。本文主要参考了衍生化气相色谱-质谱法(GC-MS)检测农药草甘膦的文献[12, 14, 15], 旨在建立血液中草铵膦的衍生化GC-MS检测方法。
GC-MS联用仪, 配有自动进样器(日本Shimadzu公司); 远红外辐射干燥箱(上海浦东跃欣科学仪器厂)。
草铵膦标准品由公安部物证鉴定中心提供, 用蒸馏水(屈臣氏)配制成1.0 mg/mL的储备液, 冷冻保存; 100 µ g/mL草铵膦工作液冷冻保存, 使用期1年。
所用有机溶剂均为分析纯, 购自国药集团化学试剂有限公司。
空白血为北京市红十字血站购买。
色谱柱:DB-5MS毛细色谱柱(30 m× 0.25 mm× 0.25 µ m)或其他等效柱; 升温程序:100 ℃保持1 min, 以10 ℃/min速率升温至280 ℃, 保持20 min; 进样口温度280 ℃; 载气为氦气, 流速为1.0 mL/min; 电子轰击能量70 eV, 传输线温度260 ℃, 离子源温度250 ℃; 扫描方式为全扫描(SCAN), 扫描质量范围40~450 amu, 溶剂延迟3 min; 进样方式为分流进样, 分流比为10:1。
草铵膦的乙酸酐衍生化GC-MS谱图见图2~3, 保留时间为12.905 min, 特征离子为m/z 56、150、192。
 | 图2 草铵膦乙酸酐衍生化/气相色谱-质谱法总离子流图Fig.2 TIC of glufosinate ammonium derivatized with acetic anhydride/propionic anhydride to undergo into GC/MS |
根据草铵膦易溶于水的特点, 选择大极性的有机溶剂作为提取溶剂, 本文采用实验室常用提取溶剂甲醇/乙腈(2:8, 体积比)进行提取。
采用常规方法吡啶和乙酸酐法进行草铵膦的衍生化时, 未检出目标物, 因此本实验参考文献[15], 并用实验室常备试剂乙酸酐代替文献中使用的丙酸酐, 用甲醇:乙酸酐(1:1)进行衍生化, 甲醇做溶媒, 结果证明完全可行。该衍生化方法需在无水条件下进行, 否则衍生化产率不高, 且衍生化产物还会分解, 影响检测结果, 所以提取液要挥干。实验采用酸酐为衍生化试剂, 为避免多余的酸酐损坏色谱柱, 所以衍生后要将衍生化试剂完全挥干后再用乙腈定容分析。关于溶媒、衍生化时间、衍生化方式选择见表1。
| 表1 溶媒、衍生化时间、衍生化方式选择实验结果 Table 1 Selection of menstruum, time and mode for derivatization through experiment |
由表格可知, 参考文献[15]中衍生化时间为4 h, 作者为节省时间衍生化2 h, 结果未检出目标物, 因此水浴衍生时仍采用文献上报道的时间4 h; 而使用干燥箱衍生化产率明显高于水浴衍生化的产率, 接近2倍关系, 故本实验采用干燥箱进行衍生化。
采用甲醇:乙酸酐(1:1)在干燥箱中100 ℃衍生, 衍生化时间为0.5、1、2、3 h时, 目标物特征离子峰面积值接近一致, 而衍生时间为4 h时, 目标物特征离子峰面积值下降近1/4。而血液添加标准品使用干燥箱衍生化, 时间选用0.5 h时未检出目标物, 而衍生化时间为1 h时检出目标物, 作者认为血液中的脂类物质干扰了衍生化产物的生成, 因此衍生化时间定为1 h。
使用干燥箱衍生化时, 血液添加样品和标准品衍生化实验结果均表明80 ℃衍生优于100 ℃衍生, GC-MS分析时衍生化产物受杂质干扰较少, 定量准确。
取空白血1 mL, 5份, 分别添加草铵膦标准品0.5、1.0、5.0、7.5、10.0 µ g, 按1.3操作, 以特征离子m/z 150的峰面积为纵坐标, 添加量为横坐标, 绘制工作曲线。
取空白血2 mL, 3份, 每份添加草铵膦标准品1.0 µ g, 按1.3操作, 以特征离子m/z 150的峰面积计算相对标准偏差RSD%, 数据见表2。
| 表2 血液中草铵膦的准确性测定(0.5 ug/mL, n=3) Table 2 Repeatability (accuracy) of glufosinate ammonium tested from whole blood, 0.5 ug/mL, n=3) |
结果表明草铵膦在0.5 ~10 µ g/mL范围内线性良好, 工作曲线为y=324826x+30384, R2=0.997 5, RSD%(n=3)为3.2%, 满足刑事技术实验室的定量检验要求。
取空白血每份1 mL, 分别添加草铵膦标准0.1、0.2、0.5、1.0、2.0 µ g, 按1.3操作。结果血液中草铵膦的最小检出限为0.2 µ g/mL, S/N=45:1。
采用甲醇/乙腈(2:8, 体积比)溶剂进行提取净化、甲醇:乙酸酐(1:1)衍生化, 建立了血液中草铵膦的衍生化GC-MS分析方法。该方法衍生化温度为80 ℃, 衍生化时间为1 h, 最小检出限为0.2 µ g/mL(S/N=45:1)。该方法简便、易操作, 适用于相关刑事技术案件的检验。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|