第一作者简介:孙启凡,女,山东枣庄人,博士,副主任法医师,研究方向为法医遗传学。E-mail:sunqifan@cifs.gov.cn
目的 研究判断常规试剂盒所提RNA中残留的基因组是否会对后续RNA检测产生影响并建立相应的纯化应对策略。方法 使用miRNeasy® Mini Kit提取外周血和月经血样本中的RNA,用TURBO DNA-free™ Kit对部分RNA纯化,通过紫外荧光定量、琼脂糖凝胶电泳、实时荧光定量检测等方法对比纯化前后是否存在显著差异性,并使用琼脂糖凝胶电泳以及毛细管电泳DNA分型扩增来判断外周血样本中提取的RNA是否有基因组残留。结果 使用试剂盒进行DNA纯化后可有效去除残留的基因组DNA。纯化后的RNA浓度较纯化前大都有所下降;琼脂糖电泳结果显示纯化后无DNA条带,RNA条带纯化前后差异不大,完整性良好;RNA实时荧光定量检测结果显示单个microRNA(miRNA)在纯化前后有些会存在总量上的差异,但6种miRNA在外周血和月经血中相对表达量高低始终保持一致。结论 常规RNA提取试剂盒所提RNA中含有的DNA会影响部分miRNA检测结果,但不会影响对体液组织属性来源的判定。对提取的RNA进一步纯化可有效去除基因组DNA残留,但同时会影响RNA总量。要根据实际研究需要,决定是否应该予以纯化。
Objective To determine whether the genomic DNA residue in RNA extract affects the detection of miRNA.Methods RNA was extracted from peripheral or menstrual blood sample with miRNeasy® Mini Kit, followed with TURBO DNA-free™ Kit to have it purified. After assessed of its quality by UV spectrophotometer, the RNA was undergone with both agar-gel and capillary electrophoresis, with the expression levels of six miRNAs being respectively tested by real-time PCR.Results The results showed that the concentration of the purified RNA decreased slightly, compared with the RNA of pre-purification. Furthermore, according to the agarose gel and capillary electrophoresis, the residual genomic DNA was found of deprived from the extracted RNA samples, without affecting the integrity of RNA. Although the real-time PCR revealed that some miRNA had discrepant amount before and after purification, yet the relative expression levels of six miRNAs commonly kept their almost intact consistence in both the peripheral and menstrual blood regardless of purification.Conclusion The genomic DNA residue in RNA extract does affect the detection of some miRNA, however not affecting the identification of what tissue to have the body fluid left. Whether to purify or not depends on the research purpose.
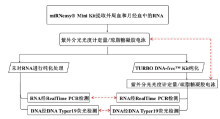
在法医学领域, RNA分析因其具有高灵敏度和高特异性, 兼容目前的DNA提取、分析流程以及节约实验成本等优势而表现出极大的应用潜力。大量的研究证明, 无论是信使RNA(messenger RNA, mRNA)还是非编码RNA(non-coding RNA , ncRNA), 在体液斑迹组织来源鉴定、机体死亡时间推断、年龄推断、同卵双生子甄别等方面都具有良好的应用潜能[1, 2]。MicroRNA(miRNA)是一类广泛存在于真核细胞中由约18~25个核苷酸组成的内源性非编码小分子RNA[3, 4], 与mRNA相比, miRNA具有片段短小、不易降解的特点, 很大程度上能弥补mRNA不稳定、易降解的缺点, 因而成为法医学研究的热点[5]。其中, RNA样本提取作为实验分析的基础步骤, 是保证实验结果准确性和可靠性的关键。尤其miRNA本身表达量较低, 故提取高质量的RNA对后续miRNA的检测极为重要。现有的RNA分析方法均为先提取样本总RNA, 然后通过逆转录PCR或者设计相应引物探针以针对性地检测某类RNA, 如miRNA。本实验室之前探索了市场上常用商业试剂盒的提取RNA能力, 证明miRNeasy® Mini Kit凭其节约时间、所提RNA质量较高等优点胜出[6]。但实验发现该试剂盒提取到的RNA含有部分DNA污染, 这些DNA污染是否会对后续miRNA的检测产生影响, 目前并无相关研究报道。因此本研究利用RNA纯化试剂盒TURBO DNA-free™ Kit对从外周血、月经血中提取的RNA进行纯化, 比较各个样本纯化前后RNA的浓度、纯度和完整性, 并对纯化前后的样品分别进行RNA的实时荧光定量检测, 判断RNA中DNA对miRNA检测的影响, 以期为后续合理利用总RNA来检测miRNA提供研究依据。同时使用DNA TyperTM19试剂盒进行DNA分型检测, 以判定纯化试剂盒TURBO DNA-free™ Kit去除基因组DNA的能力, 为相关研究提供参考。
根据知情同意原则采集5位健康女性个体(年龄23~30岁)外周血5份, 月经血5份, 其中外周血为静脉采血获取, 实验使用量为200 μ L, 月经血通过医用棉签充分蘸取, 实验时选用2根棉签用于提取。提取前所有样本在-80 ℃条件下存储。
RNA提取:用miRNeasy® Mini Kit(Qiagen, 德国)提取上述样本中的RNA, 按说明书操作。
RNA纯化:采用TURBO DNA-free™ Kit (Invitrogen, 美国)对提取的部分RNA进行纯化, 步骤如下:1)加入0.1倍体积10× TURBO DNase Buffer 和1 μ L TURBO DNase到RNA中, 轻轻混匀; 2)37 ℃孵育20~30 min; 3)重悬, 加入0.1倍体积的(至少2 μ L)DNase Inactivation Reagent; 4)室温孵育5 min(过程中轻弹2~3次); 5)10 000 g离心1.5 min, 取上清。
用nanodrop 2000c(Thermo Scientific, 美国)紫外分光光度计, 对纯化前后的各样本总RNA的浓度、OD260/280进行测定, 同一样品重复三次计算平均值。对纯化前后的各样本总RNA用1%琼脂糖凝胶电泳进行检测(120 V电压下电泳30 min), 用凝胶成像仪成像取图, 分析RNA的质量和完整性。
1.4.1 miRNA定量检测
对纯化前后的样品经反转录后进行实时荧光定量PCR检测。反转录反应体系为20 μ L, 包含4 μ L的5× First-Strand Buffer, 2 μ L 0.1 mol/L DTT(0.1 mol/L), 1 μ L反转录酶 M-MLV(200 U/μ L), 1 μ L特异茎环反转录引物(1 µ mol/L), 0.5 μ L的dNTP(10 mmol/L), 0.2 μ L的重组核糖核酸酶抑制剂Recombinant RNasin® RNase Inhibitor(40 U/μ L)和100 ng RNA样本, 剩余用去核酸酶的水补齐。反转录程序为16 ℃、30 min, 37 ℃、30 min, 65 ℃、5 min。用去核酸酶的水替代反转录酶设置阴性对照。实时荧光定量PCR反应在QuantStudioTM 7 Flex Real-Time PCR System(Applied Biosystems, 美国)上进行, 反应体系为10 μ L。扩增引物利用Primer premier 5.0软件设计。反应体系为10 μ L, 包含5 μ L PowerSYBR GreenPCR反应混合液(2× ), 4 μ L去核酸酶水, 0.5 μ L上下游引物混合物(10 µ mol/L), 0.5 μ L cDNA模板。扩增程序为95 ℃、10 min; 之后95 ℃、15 s, 60 ℃、1 min, 共40个循环; 在95 ℃、15 s, 60 ℃、1 min条件下进行熔解曲线分析。
1.4.2 统计学分析
采用SPSS 19统计分析软件进行差异化分析(其中P< 0.05为差异性显著), 以Origin 8.0软件分析作图, 比较每条miRNA纯化前后的浓度、纯度差异, 分析其在不同体液(外周血、月经血)中相对表达量的高低差异。
对纯化前后的样品使用DNA TyperTM19试剂盒(公安部物证鉴定中心)进行扩增, 扩增产物在3130 xL遗传分析仪上电泳检测, 使用Genemapper 3.2软件进行分析。
本研究以外周血和月经血为研究对象, 整个研究流程如图1所示, 每份样本相关实验重复三次。
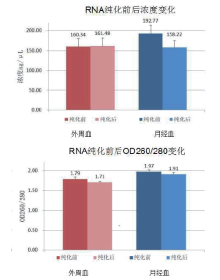
所有样品经紫外分光光度计定量, 结果如图2所示, 外周血所提RNA纯化前后浓度差异均不显著, 5个外周血样本P值平均为0.79; 月经血所提RNA纯化前后浓度差异显著性不统一, 5个月经血样本P值平均后为0.38。另外, 5个外周血所提取的RNA在不进行纯化处理之前, 其OD260/280值在1.74~1.85之间, 使用TURBO DNA-free™ Kit处理之后, 其OD值降为1.68~1.73之间(5个外周血样本P值为0.04); 5个月经血样本所提取的RNA在不进行纯化处理之前, 其OD260/280值在1.91~2.04之间, 纯化后介于1.74~2.01之间(5个月经血样本P值为0.123)。
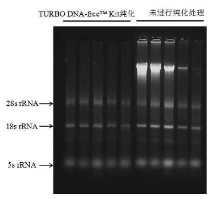
对外周血样本提取的RNA产物, 使用试剂盒TURBO DNA-free™ Kit进行纯化, 经1%的琼脂糖凝胶电泳检测, 结果如图3所示, 未进行纯化处理之前样品中可看到明显的DNA条带, 纯化之后未见DNA条带并且28s rRNA、18s rRNA和5s rRNA三个条带完整、清晰, 其亮度与未进行纯化处理的条带亮度相近, 片段大小一致, 说明RNA完整性较好。
对外周血样本提取的RNA产物纯化前后在相同条件下进行DNA基因分型检测, 使用TyperTM19试剂盒, 图4显示纯化前的样本可以成功检测出包括Amel和18个STR在内的全部基因座(图4a), 纯化后则未检测出任何基因分型(图4b), 说明使用TURBO DNA-free™ Kit(Invitrogen)可以有效去除所提RNA中的基因组DNA残留。
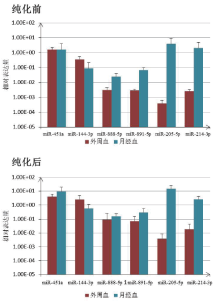
miRNA451、miRNA144-3p、miRNA888-5p、miRNA891-5p、miRNA205-5p、miRNA214-3p及内参基因RNU6b是用于不同体液斑迹组织来源区分的常用分子marker, 对纯化前后的样品中这6条miRNA经内参基因RNU6b校正后的相对表达量进行分析[7], 以判定纯化对其检测能力的影响。本实验结果表明纯化前后的RNA均可得到清晰的扩增曲线。各条miRNA在同一样本纯化前后的Δ Ct(=Ct目标基因- CtRNU6b)值有差异, 有些位点差异显著(P< 0.05, 6条miRNA在外周血中的Δ Ct, miRNA451、miRNA144-3p、miRNA888-5p、miRNA891-5p在月经血中的Δ Ct值), 而有些位点差异不显著(P> 0.05, miRNA205-5p、miRNA214-3p在月经血中的Δ Ct值), 如图5所示。
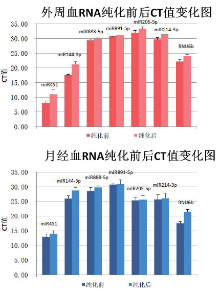 | 图5 样本纯化前后目标miRNA Ct值对比Fig.5 Comparison of Ct value between different miRNAs out of either peripheral or menstrual blood before and after purification |
笔者在前期研究中曾使用不同miRNA的相对表达量高低判定组织体液类型的研究方案[7], 从图6可以看到, 虽然对于某个miRNA来讲, 纯化前后miRNA相对表达量可能存在显著差异, 但各条miRNA在不同体液中(本研究中的外周血和月经血)的相对表达量高低仍保持相对一致。
miRNA片段短, 稳定性高, 特异性强, 多项研究证明了其在法医学实践中的应用潜力, 但因其存在表达量低和提取相对困难等不足, 又使得利用其检测、建立cDNA文库及表达和调控等研究存在着重要障碍[8, 9]。针对RNA提取的商业化试剂盒所利用的阴离子交换柱, 可选择性结合RNA, 能极大程度地滤去蛋白质和其他小分子杂质。miRNeasy® Mini Kit是本实验室前期筛选出来的相对理想的提取试剂盒, 但是提取的RNA中仍然含有基因组DNA残留。
为进一步判断miRNeasy® Mini Kit所提RNA中含有的基因组DNA是否影响miRNA的检测结果, 本研究利用TURBO DNA-free™ Kit对所提部分RNA进行纯化, 并对纯化前后的样品进行综合比较分析。发现纯化可有效去除RNA中含有的DNA, 经纯化后的样本使用常用STR试剂盒无法检测出STR信息, 而纯化前的样本可检测出完整的信息。紫外分光光度计粗定量显示RNA的浓度会略有降低, 进一步使用荧光定量PCR方法检测, 结果也相一致, miRNA呈现了不同程度量的降低。考虑到增加实验步骤, 可能导致实验样本的损耗, 从而使总量降低, 本实验选择了使用RNU6b矫正, 以相对表达量数据来评价基因组DNA纯化前后对不同miRNA检测结果的影响, 不同种类的miRNA显示出不同的结果, 部分miRNA纯化前后有较为显著的量的差异, 部分miRNA则差异性不显著。另一方面, 不同种类的miRNA在不同体液中(本研究中的外周血和月经血)的相对表达量高低保持一致, 不影响使用这些miRNA组合来判断样本体液来源。因此在对体液组织来源进行研究时, 可以不对样本中的残留DNA进行纯化操作。但这些残留DNA的存在是否会影响诸如RNA印记杂交、RNA测序, 以及是否会影响其他的非编码RNA如小干扰RNA(small interfering RNA, siRNA)、长链非编码RNA(long non-coding RNA, lncRNA)以及mRNA等的检测, 还有待进一步研究。因此在研究过程中, 应根据实际研究需要, 选择是否对所提取的总RNA作进一步DNA纯化。对于发现纯化与否对结果判定影响较大的研究, 可使用诸如TURBO DNA-free™ Kit的试剂纯化。此外, 本研究提示使用miRNeasy® Mini Kit提取的总RNA, 一部分可进行miRNA检测以做体液来源判断, 一部分可直接作为模板进行DNA分型检测, 这也为最大化利用检材样本提供了好的策略参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|