第一作者简介:朱典(1983—),男,四川宜宾人,硕士,副主任法医师,研究方向为法医遗传学。E-mail: 834190@163.com
目的 建立基于微滤技术分离检验人血中脱落上皮细胞的新方法。方法 选用微孔滤膜并构建细胞分离过滤平台,优化过滤参数;制备15组混合细胞悬液,每组包含2个等比例混合的样本,1个进行常规DNA检验,另1个经过滤平台过滤,取滤膜作DNA检验,对比两者的STR分型结果,评判过滤平台的细胞分离效果。结果 当流量为250mL/h、滤膜孔径30µm时,白细胞滤除率可达90%以上,而脱落上皮细胞截留率不低于70%;对15组混合细胞悬液经分离检验,14组获得预期结果。结论 该方法可用于人血中脱落上皮细胞的分离检验,能够改善此类检材中目的细胞的STR分型结果,为刑事案件中血迹浸染的烟蒂等混合生物检材的细胞分离检验提供了一种新思路。
Objective To establish a new method for exfoliated epithelial cells to isolate from the contaminated human blood based on microfiltration technology.Methods A filtering platform was built from the selected microfiltration membrane for cell isolation, with optimization of the items of pore size and flowing rate. 15 groups of equally-pair-mixed individual-different cell suspensions were prepared, with each group containing two identical suspensions, one of which was directly treated with the routine standard DNA extraction/test and the other firstly with the filtering platform and then undergone the DNA release and harvest so that the STR typing was carried out and compared with the corresponding standard one.Results When flowing rate is at 250mL/h and membrane-pore of 30µm, the removal of white blood cells reaches up to 90%, with more than 70% of the exfoliated epithelial cells being retained. 14 out of the 15 groups of the suspensions meet the desired requirements.Conclusions The method is applicable to the isolation of exfoliated epithelial cells in human blood, helpful to optimize the STR typing of the target cells in mixed samples, thus providing a new approach in dealing with mixed biological samples, e.g., the blood-stained cigarette butts.
刑事案件中, 嫌疑人遗留在现场的血迹浸染的烟蒂、手套等人血与脱落上皮细胞混合的生物检材屡见不鲜。由于受害人血的污染, 常规DNA检验结果多为混合STR(短串联重复序列)分型, 甚至因污染人血的优势扩增而导致仅获得受害人的单一STR分型, 这不仅增加了结果分析的难度, 更可能丢失指证犯罪嫌疑人的重要证据。目前, 法医学中关于混合生物检材细胞分离的方法主要有:免疫磁珠定向捕获、流式细胞仪、显微捕获、激光捕获显微切割、微流体芯片技术等, 上述方法虽可高精度地定向捕获目的细胞, 但也存在着样本前处理繁琐、设备耗材昂贵、操作复杂等诸多问题, 难以在基层公安机关DNA实验室推广应用。
微滤技术, 其基本原理属于筛网过滤, 在静压差的作用下, 利用膜的“ 筛分” 作用, 小于膜孔的粒子可通过滤膜, 大于膜孔的粒子则被截留到膜面上, 从而使大小不同的组份得以分离 [1], 而使其成为一项成熟、简便的分离技术[2], 便利于大小不同的人体细胞的分离。Ladd等[3]将11 µ m的尼龙膜置于经特殊处理的2 µ m滤膜之上, 制作成了双膜过滤器ISOPORE Track-Etch Filter, 被消化过的二倍体细胞的DNA及杂质能通过此膜, 而精子细胞则被滞留于膜表面, 从而实现了精子细胞的分离。邵武等[4]利用相似的原理, 取精阴混合斑检材经第一步消化后的混合液, 加入精子富集柱中离心, 使小分子物质透过, 而精子细胞被特异性粘附和拦截在富集层中而被分离。这些方法均属于微滤技术在法医遗传学领域细胞分离检验中的应用, 但其受限于制作工艺, 分离效果或并不理想。随着材料学及制备工艺的发展, 尤其是精密加工技术的不断进步, 微滤技术在白细胞过滤分离[5, 6]、循环肿瘤细胞分离捕获[7, 8]等医学领域正发挥着重要的作用, 体现出高选择性、高分离效率、装置简单、操作便捷等优特点。本文基于微滤技术建立细胞分离装置, 探索解决上述难题的新方法。
QubitTM 3荧光定量仪(Thermo Fisher scientific, US), 9700型PCR扩增仪(Applied Biosystems corporation, US), ABI3500xL型遗传分析仪(Applied Biosystems corporation, US), ID Plus PCR扩增试剂盒(Applied Biosystems corporation, US), Magattract® M48 DNA Manual kit(Qiagen, Germany), 尼龙网隔膜(Merck Millipore corporation, Ireland), Swinnex可换膜过滤器(Merck Millipore corporation, China), 高精度一次性流量输液调节器(DELTA MED s.r.l, Italia), 一次性输液器, 一次性注射器(5 mL)。按知情同意原则选取并采集多名志愿者的血样与口腔拭子。
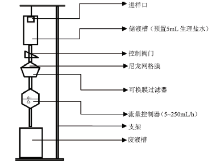
利用一次性输液器构建储液槽、流体通路和控制阀门的装置组合体; 利用尼龙网格膜、可换膜过滤器(直径25 mm)构建滤芯, 利用高精度一次性流量输液调节器的流量调节器(5~250 mL/h, 可达容积泵精度)构建流量控制器, 将上述各部件组合集成为用于细胞分离检验的过滤平台, 如图1。
1.3.1 滤膜孔径
人血中的红细胞、白细胞以及血小板, 其直径范围分别为5~9、7~20、2~4 µ m, 而脱落上皮细胞直径范围为40~60 µ m, 因此利用细胞直径大小不同可对其进行物理分离, 故滤膜孔径应介于两者之间(20~40 µ m), 而商品化尼龙网格膜的孔径在此范围内的仅有30 µ m一种, 故选择孔径30 µ m的尼龙网格膜(图2)作为过滤平台的滤膜。
 | 图2 孔径30µ m的尼龙网格膜(放大20× 10倍)Fig.2 Nylon filtering membrane with a pore size of 30µ m (magnified to 20× 10fold) |
1.3.2 流量
不同流量下的白细胞滤除率:取4个1.5 mL EP管, 各取2 µ L 1号志愿者的血样, 并分别加入1 mL生理盐水, 涡旋振荡10 s, 用1000 µ L移液器反复吹打, 制备为血细胞悬液; 取其中1管, 13 000 r/min离心3 min去上清液, 沉淀物备检(对照组); 其余3管利用上述过滤平台, 以不同流量(60、120、250 mL/h)过滤, 取下滤膜分别置于3个1.5 mL EP管内备检(过滤组1、2、3); 向以上4个EP管内加入300 µ L G2裂解液(来自Magattract® M48 DNA Manual kit)和20 µ L蛋白酶K(10 mg/mL), 56 ℃孵育2 h, 用Magattract® M48 DNA Manual kit进行磁珠纯化, 将提取到的DNA用QubitTM 3荧光定量仪定量, 依据公式“ [(对照组DNA定量值-过滤组DNA定量值)/对照组DNA定量值]× 100%” 计算不同流量下的白细胞滤除率。对2、3、4、5号志愿者血样, 同样做上述实验。结果显示, 流量为250 mL/h时, 该过滤平台的白细胞滤除率可稳定保持在90%以上(表1), 平均滤除率93.6%, 效果最佳。
| 表1 不同流量下的白细胞滤除率 Table 1 Removal of white blood cells under the varied flowing rates |
不同流量下脱落上皮细胞的截留率:取1号志愿者口腔拭子1枚, 剪下棉头置于1.5 mL EP管内, 加入1mL生理盐水, 涡旋振荡10 s, 8000 r/min套管离心5 min去载体, 沉淀物及上清液涡旋振荡10 s, 用1000 µ L移液器反复吹打, 制备为脱落上皮细胞悬液; 取100 µ L细胞悬液置于1.5 mL EP管内, 13 000 r/min离心3 min去上清液, 沉淀物备检(对照组); 另分别取100 µ L细胞悬液, 以不同流量(60、120、250 mL/h)过滤, 取下滤膜分别置于3个1.5 mL EP管内备检(过滤组1、2、3); DNA纯化提取及定量参照白细胞滤除率的检测, 依据公式“ (过滤组DNA定量值/对照组DNA定量值)× 100%” 计算不同流量下的脱落上皮细胞的截留率。对2、3、4、5号志愿者口腔拭子, 同样进行上述实验。结果显示, 流量为250 mL/h时, 该过滤平台的脱落上皮细胞截留率不低于70%(表2), 平均截留率82.6%, 效果最佳。综合实验结果, 本研究将细胞分离的流量设定为250 mL/h。
| 表2 不同流量下的脱落上皮细胞截留率 Table 2 The retained exfoliated epithelial cells under the varied flowing rates |
取一志愿者口腔拭子1枚, 参照1.3.2制备脱落上皮细胞悬液, 并各取100 µ L置于2个1.5 mL EP管内, 每管加入另一志愿者血样2 µ L, 涡旋振荡10 s, 制备为混合细胞悬液; 取其中1管, 13 000 r/min离心3 min去上清液, 沉淀物备检(对照组); 取另1管加入过滤平台储液槽, 用1000 µ L移液器反复吹打, 打开控制阀门过滤, 待储液槽液体将流尽时加入5 mL生理盐水, 保持原流量冲洗储液槽及通路, 排空液体后, 取下滤膜置于1.5 mL EP管内备检(过滤组); 参照1.3.2对过滤组和对照组进行DNA纯化提取, 产物用ID Plus PCR扩增试剂盒(9 µ L扩增体系+1µ L DNA模板)在9700型PCR扩增仪上进行扩增(28个循环), 用ABI3500xL型遗传分析仪测序。取不同志愿者口腔拭子及血样, 重复上述实验, 共15组。
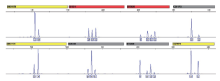
通过对15组对比实验进行分析得出:1)其中11组实验, 对照组获得两人完整的混合STR分型, 有7组过滤后获得的STR分型与脱落上皮细胞来源的STR分型完全一致(图3), 另有4组过滤后获得的STR分型, 不低于13个基因座与脱落上皮细胞来源的STR分型一致。2)其中3组实验, 对照组获得不完整混合STR分型, 部分基因座脱落上皮细胞来源的特有谱带丢失, 但过滤后获得了完整的混合STR分型(图4)。3)其中1组实验, 对照组与过滤组均为两人完整的混合STR分型, 但后者脱落上皮细胞来源的谱带成为了主峰(图5)。
本文旨在建立基于微滤技术分离人血中脱落上皮细胞的新方法。其原理是利用细胞的大小差异进行物理分离, 从而显著提高脱落上皮细胞的检材占比, 削弱污染性白细胞来源的DNA优势扩增, 以此改善混合生物检材中目的细胞的STR分型。预期结果:1)混合STR分型转化为脱落上皮细胞来源的STR分型(≥ 11个位点); 2)白细胞来源为主的不完整混合STR分型转化为两者的完整混合STR分型; 3)白细胞来源的STR分型转化为两者的混合STR分型(≥ 13个位点完整混合)。
应用构建的过滤平台对混合细胞悬液进行15次分离检验, 14次获得预期结果, 提示该方法可用于人血中脱落上皮细胞的分离检验。虽然其效果尚受白细胞与脱落上皮细胞比例的影响, 尤其是当白细胞占比较大而又未呈现明显优势扩增的时候, 对照组和过滤组获得的均是两者完整的STR分型, 因而未能达到预期效果, 但此种情况却可更有利于从中拆分出白细胞来源的STR分型。法医遗传学检验领域, 混合生物检材的细胞分离一直是研究的重点和难点, 除血细胞和脱落上皮细胞的组合外, 常见的还有精阴混合斑(精子细胞Φ 5~9 µ m、阴道上皮细胞Φ 40~60 µ m)等其他混合类检材, 根据它们当中细胞来源的差异与大小不同, 应用本文或有关改进方法, 可实现对其细胞的分离与检验。基于微滤技术建立的细胞分离检验方法还可做如下改进:1)对混合检材前处理步骤优化, 以提高载体上细胞的洗脱率; 2)尝试将滤膜整合入套管, 联合过滤平台实现二重过滤, 降低杂质、血凝块等对分离效果的影响; 3)构建多种孔径滤膜的复合过滤平台, 同时完成不同大小的细胞分离及收集; 4)对滤膜表面进行修饰, 增强细胞截留的特异性, 提高目的细胞的回收率, 从而可进一步提升该方法的分离检验效果, 拓展其适用范围, 不断挖掘其在实际检案中的应用价值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|