第一作者简介:李冉冉(1989—),女,硕士,助理鉴定人,研究方向为法医遗传学。E-mail:liranran1 @139.com
目的 比较7种不同的RNA提取方法(6种商业化试剂盒加Trizol有机提取法)的相对提取效率,为法医实践中选择提取高质量的RNA/miRNA提供参考。方法 分别使用6种不同的商业化试剂盒以及Trizol有机提取法提取晾干的外周血棉签样本,通过对RNA进行紫外荧光定量检测、琼脂糖凝胶电泳检测和测定样本中内参基因RNU6b的相对含量等方式进行评价。结果 各试剂盒所提RNA/miRNA的质量评估和表达分析结果有明显差异,其中Trizol有机提取法和试剂盒RNeasy®Mini可以得到更高质量和纯度的RNA/miRNA,170µL外周血中所提取的RNA总量可达到(3860.50±182.12)ng、纯度(OD260/280)约为1.84±0.03,且琼脂糖电泳结果显示RNA完整性好,在后续实验中表现良好。结论 在所有的提取方法中,综合考虑RNA的数量、质量以及Realtime PCR检测结果,更适合提取外周血RNA的方法为RNeasy® Mini Kit和Trizol有机提取法。
Objective To compare the seven commonly-used commercially-available RNA extraction kits and relevant methods (six commercially available extraction kits plus Trizol organic extraction suite) so as to assess their relative effectiveness of yielding RNA/miRNA.Methods Dried peripheral bloods were taken as the samples for the RNA to extract respectively by the seven selected methods. RNA quality was evaluated with UV spectrophotometry, agar-gel electrophoresis and quantitative PCR expression analysis.Results It was showed that different methods exhibit considerable discrepancy for either the quality or expression levels. Both Trizol organic RNA extraction suite and RNeasy® Mini Kit can get RNA/miRNA of good quantity and quality (From 170µL peripheral blood, the total obtained RNA quantity >1353.50 ± 78.87ng, OD260/280 >1.84 ± 0.03), rendering the yielded RNA to be of good integrity as revealed by agar-gel electrophoresis.Conclusion From overall comprehension by the quantity, quality and quantitative PCR-based expression analysis, the RNeasy® Mini Kit and Trizol are more suitable for extracting RNA/miRNA from peripheral blood.
微RNA(MicroRNA, miRNA), 因其分子量小、拷贝数高、具有组织特异性, 并且在极端外部环境如高温、强酸、强碱等条件下亦不易降解等特点而受到法医业界的关注[1, 2]。随着生物学技术的不断发展, miRNA在人类生命体中的作用也逐渐被挖掘, 越来越多的研究表明miRNA在生命过程中所起到的作用远比预想的重要。其中, miRNA在体液鉴定、死亡时间推断、年龄推断、同卵双生子甄别等方面均具有法医学可应用性[3, 4]。目前在体液鉴定和死亡时间推断方面已经取得了一定成效, 有望为法医实践中重塑案件经过、揭露犯罪事实提供科学可靠的依据。
将miRNA应用于法医实践, 要求提取到纯度高并且完整性好的miRNA。提取的miRNA的数量和质量是Realtime PCR的基础和前提。然而由于miRNA分子量小, 很难从样本中直接提取到miRNA, 所以需要提取高质量的总RNA, 从而间接评估miRNA的质量。多种针对RNA提取的商业化试剂盒陆续问世并越来越多得到使用, 本实验选取6种商业化RNA提取试剂盒, 并结合Trizol有机提取法, 对外周血中的总RNA进行提取, 以比较不同试剂盒提取RNA的纯度、产量以及RNA的完整性, 同时选取在各组织中稳定表达的基因RNU6b[5, 6], 使用Realtime PCR方法检测其表达量, 以进一步判断不同RNA提取试剂盒的实际提取效果。
根据知情同意原则采集5个无关汉族个体(年龄在23~35周岁)的新鲜静脉血液, 每个个体静脉血以移液器吸取170 µ L的等份滴于7个棉签上, 所有样本在相同条件(光照、温度、湿度、放置时间)下晾干, -80 ℃存储备用。
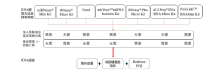
用以下7种提取方法从上述处理过的样本中提取RNA, 所有实验操作均按说明书进行, 稍作调整:1)miRNeasy® Mini 试剂盒(Qiagen, 德国); 2)RNeasy® Micro 试剂盒(Qiagen, 德国); 3)Trizol有机提取法; 4)MirVanaTM miRNA Isolation 试剂盒(Ambion, 美国); 5)RNeasy® Plus Micro 试剂盒(Qiagen, 德国); 6)ALLPrep® DNA/RNA Micro试剂盒(Qiagen, 德国); 7)PureLinkTM RNA Mini 试剂盒(Invitrogen, 美国)。整个RNA提取定量及检测流程见图1。
在提取之前用75%酒精擦拭所有仪器和设备以除去其表面的RNA酶和周围环境中的核酸。并且只用去除了RNA酶的试剂和耗材提取RNA[7]。晾干的静脉血棉签在提取之前置于2 mL EP管中, 加入500 µ L Depc水后涡旋震荡, 室温15 min孵育后将溶解产物与固体棉签分开, 尽量吸干棉签上液体而后丢弃棉签, 液相用于后续提取。
上述7种提取方法都可从组织或者细胞中提取包括miRNA在内的总RNA, 每个提取方法除了图1展示的在加入裂解液后是否需要液相分离、是否需要β -巯基乙醇(β -mercaptoethanol)的区别外, 各自仍需注意的步骤, 详见各说明书。
每种提取方法重复3次实验。
1.3.1 RNA质量检测
用nanodrop 2000c(Thermo Scientific, 美国)紫外分光光度计测定总RNA的浓度、OD260/280, 总RNA纯度由OD260/280判断。
在测定每一个样本之前都要用nuclease-free water来校正, 以避免样本之间交叉污染。
1.3.2 RNA完整性分析
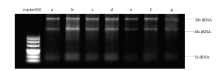
用1%琼脂糖凝胶电泳检测总RNA的完整性(120 V的电压下电泳30 min), 用凝胶成像仪成像取图, 要求总RNA样品电泳条带清晰, 28S rRNA条带亮度不低于18S rRNA条带的亮度。
选用管家基因RNU6b, 采用SYBR Green技术进行Realtime PCR检测, 样本经反转录后在QuantStudioTM 7 Flex Realtime PCR System (Applied Biosystems, 美国)上进行检测, 所有样本反应体系及参数设定均相同。
1.4.1 反转录
反转录反应体系为20 μ L, 包含10.3 μ L去核酸酶水, 4 μ L的5× First-Strand Buffer, 2 μ L 0.1 mol/L DTT, 1 μ L反转录酶 M-MLV(200 U/μ L), 1 μ L特异茎环反转录引物(1 µ mol/L), 1 μ L的MicroRNA样本, 0.5 mL的dNTP(10 mmol/L), 0.2 μ L的重组核糖核酸酶抑制剂Recombinant RNasin® RNase Inhibitor(40 U/μ L)。反转录程序为16 ℃30 min, 37 ℃30 min, 65 ℃5min。用去核酸酶的水替代反转录酶设置阴性对照。
1.4.2 Realtime PCR
Realtime PCR反应在QuantStudioTM7 Flex Realtime PCR System (Applied Biosystems, 美国)上进行, 反应体系为10 μ L。扩增引物利用Primer premier 5.0软件设计。Realtime PCR反应体系为10 μ L, 包含5 μ L PowerSYBR Green PCR反应混合液(2× ), 4 μ L去核酸酶水, 0.5 μ L上下游引物混合物(10 µ mol/L), 0.5 μ L cDNA模板。Realtime PCR扩增程序为95 ℃10 min; 之后95 ℃15 s, 60 ℃1 min, 共40个循环; 在95 ℃15 s, 60 ℃1 min条件下作熔解曲线分析。
表1和表2分别展示了7种不同提取方法所提取的RNA总量和纯度。由表1可知, 不同的试剂盒所提RNA之间总量相差较大, 其中MiRNeasy® Mini试剂盒所提RNA总量最高, 平均总量在(2410.50± 189.54) ng到(3860.50± 182.12) ng之间; 其次是Trizol有机提取法所提取的RNA, 平均总量介于(1353.50± 78.87) ng与(2418.00± 307.33) ng之间; 再者是MirVanaTMmiRNA Isolation试剂盒, 其提取的RNA总量最高可达(1211.00± 250.19) ng; 其他的几种提取方法提取的RNA总量差别不大, 相比上述3种方法, 所提取的RNA总量偏低, 大约介于(31.50± 1.50) ng到(553.00± 409.70) ng。
| 表1 7种提取方法提取的外周血的RNA总量(ng) Table 1 The gross amount of RNA extracted from the peripheral bloods by seven selected methods (ng) |
| 表2 7种提取方法提取的外周血的RNA的平均纯度(OD260/280) Table 2 The average purity (OD260/280) of the RNA extracted from peripheral bloods by seven selected methods |
由表2可见MiRNeasy® Mini试剂盒、Trizol有机提取法和PureLinkTM RNA Mini试剂盒所提RNA的OD260/280都在标准值1.80~2.0之间, 满足后续实验的需求。而RNeasy® Micro、RNeasy® Plus Micro两种试剂盒所提取的外周血RNA的纯度不完全符合标准, 样本纯度的合格率也不如上述3种方法。ALLPrep® DNA/RNA Micro试剂盒所提RNA则完全不符合标准, 纯度(OD260/280)> 2.0, 亦不符合要求。
用1%的琼脂糖凝胶对提取的RNA电泳检测, 从图2可见, MiRNeasy® Mini试剂盒、Trizol、mirVanaTM miRNA Isolation试剂盒、RNeasy® Plus Micro试剂盒、ALLPrep® DNA/RNA Micro试剂盒5种方法提取的RNA的28S rRNA的亮度明显高于18S rRNA条带的亮度, 并且28S rRNA与18S rRNA的条带都均匀且完整。RNeasy® Micro、PureLinkTM RNA Mini两试剂盒提取的RNA的28S rRNA与18S rRNA条带相对完整但稍有弥散。
通过Realtime PCR技术检测不同方法所提取样本中管家基因RNU6b的表达量, 来评价不同试剂盒的提取效能。其中Ct值(C: cycle, t: threshold, Ct值指每个反应管内的荧光信号达到设定的阈值时所经历的循环数)越小, miRNA的表达含量越高, 即提取效能越高。
由图3可见, 7种不同的提取方法所提取的RNA通过RNU6b检测均可得到清晰的扩增曲线, 表明miRNA表达良好。MiRNeasy® Mini试剂盒、MirVanaTM miRNA Isolation试剂盒、Trizol法提取的产物所对应的Ct值最小, 在16~18之间, 不同样本间Ct值相差很小; PureLinkTM RNA Mini试剂盒提取的产物对应的Ct值在18~20之间; RNeasy® Micro试剂盒提取的产物对应Ct值在17~23之间, 不同的样本之间Ct相差较大; RNeasy® Plus Micro试剂盒提取的产物对应Ct值在23~29之间, 不同的样本之间Ct相差也较大; ALLPrep® DNA/RNA Micro试剂盒提取的产物对应Ct值在23~25之间。
不同组织中的RNA受外界环境中无处不在的核糖核酸酶(RNase)以及样本保存过程中温度、保存时间、冻融次数、紫外照射与否、pH值等理化因素的影响, 提取相对困难, 这成为利用RNA进行Realtime PCR检测、建立cDNA文库及表达和调控等研究的障碍[8, 9]。理想的RNA提取试剂盒应该能够在复杂环境下从不同的检测样本中提取到充足量的RNA, 因此挑选出合适的试剂盒十分必要。本实验各提取方法皆选取相同条件处理得到的样本, 避免了样本差异对试剂盒提取结果带来的影响。
Trizol有机提取法可直接从组织或者细胞中提取总RNA, 能够迅速裂解细胞释放出RNA, 并且能够抑制细胞裂解产生出的核酸酶, 从而可保护RNA分子的完整性[10], 而用氯仿分离RNA后, 异丙醇起到沉淀RNA的作用, 在本次实验中加入异丙醇后由常规的室温放置10 min改为在-20 ℃放置4 h, 更能充分地将RNA沉淀, 提高了RNA的产量。Trizol操作简便快捷并且所用试剂(氯仿、异丙醇、乙醇等)价格低廉, 对设备的要求低, 但此方法要将裂解出来的RNA、苯酚以及其他试剂保留在同一离心管中, 不能有效去除杂质, 使得RNA的纯度较低。本实验中使用该方法提取的RNA的纯度虽符合标准, 但相比试剂盒MiRNeasy® Mini(Qiagen, 德国)纯度稍低。
试剂盒MiRNeasy® Mini(Qiagen, 德国)经QIAzol裂解液和氯仿萃取的上清, 使用阴离子交换柱而选择性结合RNA, 可滤去蛋白质和其他小分子杂质。后用Buffer RWT与RPE缓冲洗脱液, 再去除蛋白质、抑制剂和其他杂质。该方法既有效去除杂质又兼具浓缩功能, 因而能获得浓度高、纯度好的RNA样本, 且操作简单、耗时短。
其他4种试剂盒RNeasy® Micro、ALLPrep® DNA/RNA Micro、RNeasy® Plus Micro、PureLinkTM RNA Mini其提取方法均使用β -巯基乙醇(β -mercaptoethanol), 对皮肤、上呼吸道粘膜以及眼睛会有一定损伤, 并且试剂盒PureLinkTM RNA Mini的裂解和洗脱缓冲液都含有异硫氰酸胍, 直接把漂白剂或者酸性液体加入包含异硫氰酸胍缓冲液或者样品准备的废液中, 会导致反应产生化合物和有毒气体, 对操作者有可能造成损伤。由此, 7种方法的提取产物经过nanodrop 2000c定量、琼脂糖凝胶电泳和Realtime PCR检测, 综合比较可知, 试剂盒MiRNeasy® Mini、Trizol提取法提取的RNA质量更优, 总量也高于其他试剂盒; 提取的RNA纯度还高, OD260/280都在标准值1.80~2.0之间, 表明所提RNA杂质少, 蛋白质、酚类去除充分; 并且提取的RNA中28S rRNA条带的亮度明显高于18S rRNA、条带又都均匀完整, 不存在弥散现象, 显示提取的RNA完整、纯度高且没有降解。
综上可见, Trizol提取法和试剂盒MiRNeasy® Mini均可用于外周血中RNA的提取, 但从节约时间, 提高RNA质量的角度考虑, MiRNeasy® Mini试剂盒更宜作为优选方案。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|