第一作者简介:杨旸(1986—),男,河南安阳人,博士,助理研究员,研究方向为军事分析化学。E-mail:18510329382@163.com
目的 基于对糜烂性毒剂芥子气(HD)中毒后尿液样本的溯源性分析需求,建立芥子气染毒尿样的样品前处理方法,以及气相色谱-三重四极杆串联质谱检测硫二甘醇亚砜(TDGO)的高灵敏度和专属性检测方法。方法 依次采用盐酸酸化、阳离子交换固相萃取、七氟丁酰咪唑(HFBI)衍生方法处理尿样,气质联用分析采用DB-17MS弹性石英毛细管柱(30m×0.25mm×0.25μm),柱温程序为50℃(2 min),20℃/min,280℃(5min),采用选择反应监测(SRM)模式扫描,以离子对 m/ z 531→241、 m/ z317→241进行定性检验。结果 经过对前处理方法和分析条件的优化,TDGO检测限(LOD)低于1.0 ng/mL。结论 本方法灵敏、高效,解决了目前芥子气染毒检材中痕量硫二甘醇亚砜难以检验的技术难题,应用于禁止化学武器组织(OPCW)举办的首次生物医学考试中,成功对未知尿样中硫二甘醇亚砜进行了检验。
On the requirement of first biomedical proficiency test from the organization for prohibition of chemical weapons (OPCW), a method of gas chromatography (GC)-tandem mass spectrometry (MS/MS) was developed of high sensitivity and specificity based on the retrospective detection for the urine metabolized after exposure to erosive sulphur mustard (HD). The urine-contained thiodiglycol-sulphoxide, a metabolite of HD, was acidified by hydrochloric acid, then purified with the cation exchange chromatography, and finally derived by heptafluoro-butyryl imidazole (HFBI) to suit for the GC-MS analysis. Thiodiglycol-sulphoxide was determined by GC-CI-triple quadruple MS under the positive chemical ionization and selective reaction monitoring (SRM) mode, obtaining a detection limitation below 1.0ng/mL. The result shows that this metabolite can be well-determined in the 5-ml blood plasma exposed to 1.0ng/mL HD. This method has been successfully applied to retrospective detection of unknown urine samples probably exposed to HD in the first biomedical proficiency test sponsored by OPCW on biomedical sample analysis.
芥子气(HD, 2, 2´ -二氯二乙基硫醚)是一种糜烂性化学战剂, 是最危险的化学毒剂之一。当人体皮肤接触芥子气会导致严重糜烂, 同时引起呼吸系统损伤、眼睛灼伤等。芥子气的使用可最早追溯到第一次世界大战, 德国在1917年6月12日于比利时的伊普尔地区对英军使用了芥子气[1], 造成2 000多人伤亡。最近一次则是伊拉克在伊朗-伊拉克冲突中使用芥子气。近些年, 作为日本二战期间遗弃的主要化学武器[1], 芥子气弹被发现于我国的东北、东南等地, 由于炮弹腐蚀严重并泄露, 对我国人民的生命安全造成极大的威胁。并且, 由于芥子气的中毒症状有着1~12 h的潜伏期, 此间没有任何临床表现, 可能会造成误诊和诊治不及时。所以, 有必要建立快速、灵敏和准确的芥子气染毒检测方法, 为调查取证、诊断和救治提供生物体接触芥子气的直接证据。
芥子气进入生物体后迅速分布于各组织中, 主要存在形式为毒剂原型、水解氧化产物、β -裂解产物(1, 1, -磺酰基二(2-甲巯基)乙烷(SBMTE)、1, 1, -磺酰基二(2-甲亚磺酰基)乙烷(SBMSE)、1-甲基亚磺酰基-2-(2-甲巯基乙基磺酰基)乙烷(MSMTESE))和大分子加合物等。这些游离或加合的具有芥子气结构特征的化合物, 统称为芥子气的生物标志物。按照其来源和体内停留时间, 芥子气生物标志物可分为两类:小分子代谢产物和生物大分子加合物。小分子代谢产物标志物包括芥子气的水解和氧化产物, 以及与谷胱甘肽加合后的β -裂解产物, 主要有硫二甘醇(TDG)、硫二甘醇亚砜(TDGO)及β -裂解产物[2, 3, 4](图1)。尿液中以小分子代谢产物为主, 生物大分子加合标志物主要以血液为研究对象。
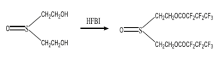
芥子气代谢产物标志物可以作为芥子气的早期暴露标志物, 在接触或染毒的早期可用于中毒鉴别和诊断。对于小分子代谢产物, 由于其在液相色谱上保留较差, 出峰靠前, 干扰较大, 液质联用检验方法有着野外现场检测不便, 环境条件要求高等仪器条件的限制, 所以对小分子代谢产物的检测大多使用应用较早、普及率高、操作便捷的气相色谱-质谱法, 已成功用于两伊战争伤员样品以及芥子气意外中毒伤员尿样的分析。文献报道的分析技术也主要是以气相色谱及气相色谱-质谱联用技术(GC、GC-MS)为主, 如采用气相色谱-三重四极杆串联质谱(GC-MS/MS)检测TDGO的衍生化产物(图2), 使用的衍生化试剂是七氟丁酰咪唑(HFBI)[5, 6]。
对于TDG、β -裂解产物的检测, 文献报道的气相色谱-质谱法检测限可达到0.5 ng/mL, 而对于TDGO的检测, 只有英国Read和Black两人建立了基于三氯化钛作为还原剂将TDGO还原还原成TDG, 而后检测TDG的间接检测方法[7, 8]。直接检测TDGO的样品制备和检测方法目标物浓度都是每毫升毫克级别, 对于低浓度的样品制备和检测方法还没有文献报道, 因此建立一套适用于低浓度TDGO的检验方法势在必行。
Thermo Trace GC Ultra TSQ quantum XLS气相色谱-三重四极杆串联质谱仪, 配备自动进样器、化学离子源(CI)和工作站(美国赛默飞世尔公司); 电子分析天平(德国塞多利斯); 恒温金属浴; 旋转蒸发仪(美国海道夫)。
芥子气(纯度95 %)和硫二甘醇亚砜(纯度95 %)均由防化研究院四所提供; 健康尿样由中国人民解放军301医院提供; 阳离子交换柱(Oasis 500 mg/3 mL); 乙腈(色谱纯, 美国Sigma-Aldrich 公司); 七氟丁酰咪唑(纯度99 %, 美国Sigma-Aldrich 公司); 甲酸(纯度> 98 %, 美国J& K公司); 超纯水(屈臣氏); 其它试剂均为国产分析纯。
1.2.1 色谱条件
色谱柱:DB - 17MS弹性石英毛细管柱(30 m × 0.25 mm × 0.25 μ m); 载气:氦气; 恒流模式, 流速1.0 mL/min; 进样口温度230 ℃; 不分流进样; 柱温程序:起始温度50 ℃(保持2 min), 升温速率20 ℃/min, 最终温度280 ℃(保持5 min)。
1.2.2 质谱条件
化学离子源, 正离子检测方式; 溶剂延迟5.0 min; 离子源温度200 ℃; 电离能量70 eV; 反应气为甲烷, 反应气流量1.5 mL/min; 碰撞气为氩气, 压力位1.0 torr; 扫描方式为选择反应监测(SRM); 硫二甘醇亚砜HFBI衍生产物的扫描条件见表1。
| 表1 硫二甘醇亚砜HFBI衍生物的SRM扫描条件 Table 1 SRM analytical condition for thiodiglycol-sulphoxide |
取TDGO约10 mg, 加入超纯水2 mL, 配成质量体积比为5 mg/mL的标准储备液。
将配制的储备液用超纯水逐极稀释成1000.0、100.0、10.0、1.0、0.1 ng/mL的标准工作液。
精密称取TDGO 50.0 mg, 置于5 mL容量瓶中, 用正己烷定容, 用乙腈逐级稀释成100.0、10.0、1.0 µ g/mL和100.0 ng/mL的TDGO储备液。
精密吸取100 µ L上述各级浓度的TDGO储备液, 分别加标至10 mL人尿液中, 混匀, 获得浓度为1 µ g/mL和100.0、10.0、1.0 ng/mL的加标尿液; 另外, 将100 µ L乙腈加标至10 mL人尿液后进行平行操作, 作为阴性对照。
上述TDGO储备液和加标样品在3~5 ℃下储存。
1.5.1 盐酸酸化尿样
取加标尿样和空白尿样各0.5 mL, 加入约100 µ L 1 mol/L盐酸溶液, 将尿样的pH值调节至4, 25 ℃静置20 min, 使用16 000 r/min转速离心, 移取上清液备用。
1.5.2 阳离子交换柱除杂
使用2 mL甲醇、2 mL水依次活化500 mg/3 mL的阳离子交换柱, 以0.5 mL/min柱流速将1.5.1制备的上清液载入并通过阳离子交换柱, 使用2 mL水淋洗萃取柱, 合并流出液和淋洗液, 用约20 µ L的25 %氨水调节pH值至中性, 用旋转蒸发仪将样品溶液蒸干。
1.5.3 七氟丁酰咪唑衍生
取200 µ L乙腈加入1.5.2蒸干样品溶液的烧瓶中, 超声振荡使瓶壁上的固体溶解到乙腈中, 再加入30 µ L HFBI, 室温下衍生5 min后进行GC-MS/MS分析。
2.1.1 尿样中硫二甘醇亚砜的分离与纯化
由于尿样基质复杂, 而且TDGO的浓度很低, 因此需要对TDGO进行纯化富集。固相萃取是纯化和富集的一种重要技术。我们考察了硅胶柱、Florisil柱、HLB柱三种不同性质的固相萃取小柱, 然而, 由于TDGO极性强、柱保留差, 这三种柱子都不能很好地保留目标物。使用硅胶柱纯化富集目标物后, 进行衍生并以气质联用法检测, 两个离子对都未检测到任何色谱峰, 说明该固相萃取柱对尿样中的目标物不能有效地保留; 使用Florisil柱时, 离子对m/z 531→ 241色谱图没有色谱峰, 离子对m/z 317→ 241在8.82 min处出现了大量的干扰峰; 而HLB柱的效果与Florisil柱类似, 杂质干扰比较严重; 使用1H NMR检测到流出液和淋洗液中都有目标物存在, 并且干扰很大, 表明这三种萃取柱均不能有效对TDGO进行纯化富集。
由于尿液中含有大量的含氮化合物, 所以考虑使用阳离子交换(SCX)柱除去这些含氮化合物。SCX柱在纯化TDGO时较上述三种柱子有着明显的效果, 但目标色谱峰8.82 min处还是受到了杂质的干扰, 信噪比较低。继而考虑酸化尿样使游离存在的含氮杂质阳离子化, 再用SCX柱纯化富集(图3)。结果显示, 尿样酸化后, SCX固相萃取柱可以达到良好的富集纯化效果。
 | 图3 酸化尿样经SCX柱纯化富集后的TDGO衍生物色谱图(左:m/z 531→ 241; 右:m/z 317→ 241)Fig.3 Chromatograms of SCX-column purified TDGO derivative from acidified urine(left: m/z 531→ 241, right: m/z 317→ 241) |
除了固相萃取柱的选择外, 淋洗条件也是目标物纯化富集的关键。为了确定最佳淋洗条件, 分别使用水、乙腈及乙酸乙酯溶液进行淋洗, 结果显示水作为淋洗液的效果最好(图4), 并且在8.82 min处基质干扰最小, 在此条件下, TDGO的样品制备回收率最高可达85 %。
 | 图4 酸化尿样SCX柱纯化、水淋洗的TDGO衍生物色谱图(左:m/z 531→ 241; 右:m/z 317→ 241)Fig.4 Chromatograms of SCX-column purified TDGO derivative from acidified urine(left: m/z 531→ 241, right: m/z 317→ 241) |
2.1.2 硫二甘醇亚砜的氟化物衍生
由于气质联用法无法直接检测TDGO, 所以采用衍生化的方法通过检测衍生产物来间接检验TDGO。为提高TDGO的检测灵敏度, 应选择电负性较高的含氟衍生化试剂。为了确定最佳的衍生化试剂, 比较了五氟苯甲酰氯和七氟丁酰咪唑两种衍生化试剂, 但是五氟苯甲酰氯衍生后的CI质谱图中碎片离子太少, 不适宜用GC-MS/MS检测, 而七氟丁酰咪唑衍生后的CI质谱图特征性碎片离子较多, 更适宜用来对TDGO进行定性分析(图5)。
除了衍生化试剂外, 衍生条件对衍生效果也尤为关键, 我们比较了在25、40、60、90 ℃四个温度下的衍生效率, 结果显示25 ℃的条件衍生即可满足检测需求。除此之外, 还考察了衍生时间对衍生效率的影响, 结果显示, HFBI作为衍生化试剂时的衍生效率非常高, 在5 min内即可衍生完全。
2.2.1 专属性
建立并优化了检测TDGO衍生产物的气相色谱条件, 保留时间为8.82 min。经气相色谱-CI-三重四极杆串联质谱SRM模式检测空白尿样, TDGO衍生物的两个特征离子对中m/z 317→ 241没有色谱峰, 离子对m/z 531→ 241有明显的色谱峰, 但干扰很大, 峰面积较小, 信噪比很小; 而按照建立的仪器分析方法对浓度为1.0 ng/mL HD的染毒尿液进行检测时, 能够检测到明显的TDGO衍生物的两个特征离子对的色谱峰, 峰面积和信噪比较空白都有明显的差别, 表明方法的专属性良好。
2.2.2 检测限
碰撞能量、离子对、扫描时间等参数直接影响到目标物的分析灵敏度。因此, 对这些参数进行了系统优化, 最终确定的条件见表1。应用此方法, 测定1.3配制的标准工作液中的目标物, 得到TDGO的检测限低于1.0 ng/mL(图6)。
 | 图6 浓度为1.0 ng/mL TDGO的衍生产物色谱图(左:m/z 531→ 241; 右:m/z 317→ 241)Fig.6 Chromatograms of TDGO derivative in concentration of 1.0 ng/mL(left: m/z 531→ 241, right: m/z 317→ 241) |
2.2.3 加标尿液样品的检测
各取不同加标浓度的TDGO尿液样品0.5 mL, 经盐酸酸化尿样、阳离子交换固相萃取柱除杂、七氟丁酰咪唑衍生等步骤, 制成50 µ L待测液。另外以空白尿样作为阴性对照, 按同样方法平行进行操作。按照1.2条件, 应用GC-CI-MS/MS(SRM)测定, 空白尿样中未检出TDGO衍生物; 在TDGO浓度为1 ng/mL的加标尿样中, TDGO衍生产物的两个特征离子对m/z 317→ 241和m/z 531→ 241在保留时间8.82 min均出峰(表2); 随着TDGO加标浓度增加至10 ng/mL和100 ng/mL, 两个特征离子对的峰面积和信噪比相应增加。
| 表2 加标尿样的检测结果 Table 2 Analytic result of spiked urine |
OPCW在首次组织的生物医学样品考试中提供了3个尿液样品(UA、UB、UC), 空白尿液自备。为了获得三个尿样详实的染毒信息, 应用了本实验室建立的样品制备方法和气质联用分析方法:取染毒尿样0.5 mL、TDGO浓度为10 ng/mL的加标尿样0.5 mL, 按照1.5方法处理样品, 按照1.2条件分析样品, 检验结果见表3。
| 表3 OPCW提供的未知染毒尿液样本的检测结果 Table 3 Analytical results of unknown-toxin-contaminated urine sample provided by OPCW |
在OPCW组织的生物医学样品考试中, 参试实验室提交所检测到的化合物后, 只有当评估实验室能够正确的检测出参试实验室报告的全部化合物时, 才能够判定参试实验室检测正确。虽然三个未知染毒尿样中的TDGO浓度很低, 但应用本方法检验, 实验结论与OPCW评估实验室的结果一致, 说明本方法对尿样中TDGO的检测可靠。
建立了人染毒尿样中糜烂性毒剂芥子气代谢产物硫二甘醇亚砜的检验分析方法, 包括盐酸酸化、阳离子交换柱纯化、七氟丁酰咪唑衍生等样品制备方法, 以及气相色谱-三重四极杆串联质谱准确检测硫二甘醇亚砜的高灵敏度分析方法。应用此方法, 可实现痕量芥子气中毒后尿样的溯源检测, 并应用到OPCW首次组织的生物医学样品考试中, 对未知染毒尿液样品进行检验, 成功检出所有芥子气染毒样品中的硫二甘醇亚砜。本方法可靠性强、易于操作, 适用于糜烂性毒剂中毒后尿样中硫二甘醇亚砜的溯源检测。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|