作者简介:杨丽君(1963—),女,河南郑州人,学士,教授,研究方向为毒品检验。E-mail:yanglj666@163.com
目的 建立一种利用胺基纳米磁珠提取血液中甲基苯丙胺、吗啡和氯胺酮的新方法。方法 将二乙胺与磁粉材料结合制成胺基纳米磁珠,在pH8.5的缓冲溶液中进行激活和洗脱。用其提取血液中甲基苯丙胺、吗啡和氯胺酮。结果 经GC-MS检测,胺基纳米磁珠可以有效富集血液中的甲基苯丙胺、吗啡和氯胺酮,回收率均高于70 %,富集倍数均大于30倍。对提取强度、pH值、洗脱液用量、标准曲线、检测限、以及日间精密度与日内精密度等影响因素的实验结果表明:当采用漩涡方式、pH大于7、洗脱液用量为80 μL时,提取率较高。结论 在GC-MS分析中,甲基苯丙胺、吗啡和氯胺酮血药浓度在0.5~10 μg/mL范围内呈线性关系, r分别是0.9826、0.9526和0.9914,最低检出限分别是0.062、0.093和0.041 μg/mL。提取甲基苯丙胺、吗啡和氯胺酮的日内精密度和日间精密度均小于6.0 %。该方法富集效率高,吸附所需时间短,能有效提高血液中常见毒品的检测灵敏度。
A new method has been developed with amino-modified nano-magnetic beads to extract methamphetamine, morphine and ketamine from human blood. The amino nano-magnetic beads, generated through combination of diethylamine with magnetic powder, were used to extract drugs from human blood. The GC/MS results showed that the produced beads effectively enriched the drugs in blood, with a recovery rate higher than 70 %. On average, the enrichment ratio was greater than 1:30. All of the important parameters were studied at the extraction strength, pH value, eluent consumption, standard curve, detection limit as well as the intra- and inter-day precisions, indicating that a higher extraction can be reached upon the employment of vortex, pH greater than 7 and the consumed elution at 80 μL. For GC/MS analysis, the linear range was from 0.5 to 10.0 μg/mL, correlation coefficients ( r) were 0.9826, 0.9526 and 0.9914, and the detective limits were individually 0.062, 0.093 and 0.041μg/mL, respectively. The intra- and inter-day precisions were both less than 6.0 %. This method is of high enrichment efficiency and short adsorption time, capable of improving the detection sensitivity of drugs in blood.
磁性纳米粒子是近年来发展起来的一种新型材料, 由于磁性纳米粒子具有特殊的磁导性、超顺磁性, 以及较易与物质分子产生吸附和键合作用, 结合成具有磁性和生物特性的双重特性微粒, 使其在生物、医学等领域得到了广泛的开发应用[1, 2, 3, 4, 5, 6, 7]。而Fe3O4纳米粒子因具有合成简单、光学性质突出和易修饰等特点, 更成为近年来磁性纳米粒子的研究重点[8-9]。
在刑事科学技术领域, 体液中毒品成分提取的传统方法主要有液液萃取, 固相萃取等[10, 11]。纳米磁珠萃取的出现, 克服了传统样品前处理分离效率低、操作复杂、有机溶剂消耗量大、易造成环境污染和损害操作人员身体健康等缺点。而将磁性纳米粒子应用到体液中毒品的提取, 罕有报道。
胺基纳米磁珠是近年新研发的一种专门用于提取人体体液中常见毒品的新材料。其提取的基本原理是:磁性Fe3O4纳米粒子表面携带的胺基功能团, 能增强纳米磁珠的比表面积和与物质分子的相容性, 从而与毒品分子能发生较好的键合反应, 使毒品被吸附到纳米磁珠表面。在磁场的作用下, 基于磁珠的磁性和胺基功能团的特性, 胺基纳米磁珠可有效吸附毒品, 而由于分子间键合反应产生的吸附不稳定, 会因更强的溶解反应释放出被吸附的毒品, 可使毒品得以提取分离。
本实验应用胺基纳米磁珠提取血液中的甲基苯丙胺、吗啡和氯胺酮等常见毒品, 旨在为体液中提取毒品提供新的思路和方法。
气相色谱-质谱联用仪(SATURN 3 GC/MS, 美国VARIAN 公司); 酸度计(PHS-3, 上海第二分析仪器厂); 漩涡混合器(XW-80A, 上海精科实业有限公司); 超声振荡器(AS20500A, 天津奥特恩斯仪器有限公司); 磁力分离器和胺基纳米磁珠(磁珠粒径大小约为80 nm, 300 mg/mL水溶液, 北京八方公司);
盐酸甲基苯丙胺(methamphetamine hydrochlotide, 缩写:MA)、盐酸氯胺酮(ketamine hydrochloride, 缩写:KET)、盐酸吗啡(morphine hydrochloride, 缩写:MOR)、SKF标准品(分析纯, 公安部物证鉴定中心);
盐酸、氢氧化钠、无水乙醇、乙酸乙酯(分析纯, 沈阳市试剂厂);
空白血样(吉林省公安厅物证鉴定中心提供)。
分别精确称取124 mg盐酸甲基苯丙胺、118 mg盐酸氯胺酮、113 mg盐酸吗啡、100 mgSKF标准品于100 mL的容量瓶中, 以无水乙醇溶解、定容, 配制成质量浓度为1mg/mL的标准储备液, -20℃冰箱中保存。
1.3.1 色谱条件
色谱柱:HP-5毛细管柱(30m× 0.25mm× 25μ m, 美国Agilent公司); 进样口温度:260℃; 柱温:初温60℃, 保持2 min, 以20℃/min升至280℃, 保持20 min; 载气:氦气(1mL/min); 分流比:无分流; 进样量:1μ L。
1.3.2 质谱条件
离子源(EI)温度:230℃; 检测器温度:280℃; 进样口温度:260℃; 质量扫描范围:m/z 50~450; 极化温度:160℃; 溶剂延迟:4 min。
取空白血样, 用蒸馏水稀释3倍, 加入毒品标准储备液, 配成血中毒品质量浓度为1μ g/mL的标准血样。
取1mL标准血样(毒品浓度1μ g/mL)置于5 mL试管中, 将20 mg/mL的纳米磁珠100μ L混入血样中, 充分混合振荡后, 将试管放到磁力分离器上, 使磁珠在磁场作用下附着在试管内壁上而与血样分离, 用移液枪将处理后血样移除。
向试管中加入少量蒸馏水, 清洗磁珠表面吸附的杂质, 重复多次, 直至清洗液干净。取80μ L乙酸乙酯洗脱液, SKF乙醇液1μ L(浓度1mg/mL)置于试管中, 进行GC/MS检验, 提取特定离子, 内标法计算回收率。
定量离子:甲基苯丙胺 m/z58; 氯胺酮 m/z180; 吗啡 m/z285; SKFm/z86。图1为空白血与空白血添加3种毒品磁珠萃取的GC/MS总离子流图。3种毒品与内标物的保留时间依次为6.731、11.262、15.754、13.967 min。
将20 mg/mL的纳米磁珠100μ L加入到1 mL标准血样中, 分别按静置、手摇振动、漩涡、超声振荡4种条件提取3min, 将试管放在磁力分离器上, 按“ 2.1” 项的操作步骤, 平行3次实验, 比较不同提取强度对毒品提取率的影响, 结果如图2。
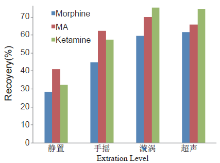 | 图2 3种毒品的不同提取强度的影响Fig.2 Influence of different extraction strength on the extraction efficiency of three drugs |
结果表明, 提取强度对提取率有一定影响。这主要由于提取强度增大, 使纳米磁珠得到充分的分散, 增加了与血液的接触面积, 加快了物质的传递过程, 热力学平衡的时间因而缩短。故本实验选漩涡为提取方式。
取空白血样, 用蒸馏水稀释3倍, 加入标准毒品储备液, 配成血中毒品质量浓度为1μ g/mL的标准血样, 分别用0.1mol/L氢氧化钠溶液、0.1mol/L盐酸调节标准血样pH为:5.5、6.5、7、8.5、9, 取不同pH条件下的标准血样(毒品浓度1μ g/mL)1mL置于5 mL试管中, 其余步骤按“ 2.1” 的磁珠萃取方法处理样品。平行3次实验, 比较不同的pH值对甲基苯丙胺、吗啡和氯胺酮提取率的影响, 结果如图3。
纳米磁珠与毒品间的吸附主要依靠范德华力, 因此基质中的分析物必须变为分子状态才能与磁珠发生吸附作用。而改变基质的pH能够改变分析物在基质中的存在形式, 如由离子形态转化为分子形态, 从而减少它们在基质中的溶解度, 增加其在磁珠上的吸附量。对甲基苯丙胺、吗啡和氯胺酮而言, 当pH大于7时, 它们均以单体的分子形式存在, 有利于磁珠对3种毒品的吸附。
取空白血样, 用蒸馏水稀释3倍, 加入毒品标准储备液, 配成血中毒品质量浓度为1μ g/mL的标准血样。每种毒品的标准血样(毒品浓度1μ g/mL)分别取1mL置于5 mL试管中, 将100μ L纳米磁珠(20 mg/mL)混入血样中, 充分混合振荡后, 用移液枪将处理后的血样移除, 用蒸馏水清洗磁珠表面杂质。分别以50、60、80、120、150μ L的乙酸乙酯, 洗脱目标物, 其余步骤按“ 2.1” 的磁珠萃取方法处理样品, 平行3次实验。结果如图4。
 | 图4 3种毒品的不同洗脱液用量对提取率的影响Fig.4 Effect of different eluent consumption on the extraction efficiency of three drugs |
结果表明, 随着洗脱液用量的增加, 毒品的提取率有所增加, 当洗脱液用量为80μ L及以上时, 提取率变化不大, 故选择洗脱液用量为80μ L。
2.5.1 标准曲线与检测限
配制血液中甲基苯丙胺、氯胺酮、吗啡质量浓度分别为0.1、0.5、1.0、5、10.0 μ g/mL的标准血样, 按照“ 2.1” 的操作步骤, 以3种毒品回收率对质量浓度绘制标准曲线, 求出直线回归方程和相关系数, 以三倍信噪比计算检测限, 结果见表1。
| 表1 3种毒品的标准曲线回归方程、相关系数及方法检出限 Table 1 Linear regression equations, correlation coefficients and the detection limits of three drugs |
2.5.2 日间精密度与日内精密度
取“ 2.5.1” 项中配制的低、中、高3种浓度的样品, 每个样品取5份, 按照“ 2.1” 项的操作步骤, 计算3种毒品的回收率。考察日内精密度(n=5), 同时连续操作3天, 考察日间精密度(n=3)。结果见表2。
| 表2 3种毒品的日内、日间精密度 Table 2 Intra- and inter-day RSDs of three drugs |
如表3所示, 本文报道的纳米磁珠提取方法同传统的萃取方法相比回收率偏低, 主要原因是由于实验中所选用的胺基纳米磁珠粒度较小(80~1000 nm), 实验中所使用的磁力分离器仅在容器的一侧产生吸附, 因此在移去样品溶液和用蒸馏水清洗磁珠表面残留杂质时易造成胺基纳米磁珠的损失, 导致回收率偏低。但70 %以上的回收率完全可以满足实际工作的需要。同时, 采用磁珠纳米材料萃取血液中的甲基苯丙胺、氯胺酮、吗啡3种毒品, 与其它萃取方法相比, 其操作简单、无有机溶剂污染, 所以本文建立的方法具有较强的实用性。
| 表3 3种毒品不同提取方法回收率的对比 Table 3 Recoveries of three drugs with different extraction methods |
将胺基Fe3O4纳米磁珠用于提取血液中的甲基苯丙胺、吗啡和氯胺酮3种毒品, 利用GC/MS对血中3种毒品的提取情况进行研究分析, 结果表明, 本文所选用的胺基Fe3O4纳米磁珠能够与上述3种毒品发生较好的吸附键合反应, 可以提取血液中的常见毒品。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|




