作者简介: 乔晋东,法医师,理学硕士,研究方向为法医遗传学。 E-mail: qiaojindong1985@163.com
目的 研究制备离子液体复合磁性纳米粒子,提高DNA提取纯化效率。方法 将具有高提取效率的离子液体作为功能单体,乙二醇二甲基丙烯酸酯为交联剂,磁流体为分散相,聚乙烯吡咯烷酮为致孔剂,偶氮二异丁腈为引发剂,采用一步悬浮聚合法制备出具有较高提取效率的超顺磁性纳米粒子,并与QIAGEN磁珠试剂盒进行比较。结果 制备的离子液体复合磁性纳米粒子化学性质稳定、分散性能良好、粒径均匀且具有超顺磁性,优于QIAGEN磁珠试剂盒。结论 离子液体复合磁性纳米粒子可用于微量生物检材DNA提取,操作过程简单方便、所用试剂环境友好、成本低廉。
Objective Aiming at the preparation of the ionic liquid composite magnetic nano-beads and their application into the trace DNA extraction to both improve the extraction efficiency and reduce the cost and requirements of the traditional magnetic-bead method.Methods The magnetic nano-beads of high extraction efficiency and superparamagnetism were synthesized with one step suspension polymerization by an ionic liquid as the monomer, ethylene glycol dimethacrylate as the cross-linker, magnetic fluid as the dispersant solvent, polyvinylpyrrolidone as the porogen, and the azodiisobutyronitrile as the initiator. The prepared ionic liquid composite magnetic nano-beads were compared with the QIAGEN kit for their efficiency to extract DNA samples of different concentration, and further used in extracting the DNA from bloodstain on a piece of criminal tool.Results The ionic liquid composite magnetic nano-beads of superparamagnetism showed stable chemical properties, good dispersion performance and uniform particle size, demonstrating their higher extraction efficiency than that by the QIAGEN kit. DNA genotyping profile was obtained from the above indicated bloodstain extracted with the newly-prepared nano-beads.Conclusions The ionic liquid composite magnetic nano-beads are simple, environment-friendly and cheap of preparation, able to extract trace DNA.
DNA提取是法医DNA检验流程中基础和关键的一步, 能否从生物检材中获得足够的高质量DNA直接影响到后续DNA的检验[1]。现在常用的磁珠法, 因其操作过程简单方便, 所用试剂环境友好, 回收率高等优点, 被广泛应用于各类生物检材的DNA提取[2, 3]。但国内实验室现在使用的一般都是进口磁珠试剂盒, 大多价格较高。本文通过一步悬浮聚合法制备出了粒径均一、具有超顺磁性的离子液体复合磁性纳米粒子, 并成功应用于DNA的提取。该粒子综合了离子液体的高提取纯化效率[4, 5, 6], 价格低廉和纳米粒子的优点, 可替代进口, 具有开发成国产试剂的潜质。
AB-3130XL型测序仪(美国AB公司); GeneAmp® 9700型扩增仪(美国AB公司); M48磁珠DNA提取试剂盒(德国QIAGEN公司); AmpFlSTR Identifiler 扩增试剂盒(美国AB公司); 乙二醇二甲基丙烯酸酯(EDMA, 美国ACROS公司); 偶氮二异丁腈(AIBN, 上海天莲精细化工有限公司); FeCl2· 4H2O, FeCl3· 6H2O, 聚乙烯吡咯烷酮, 油酸, 氨水, 氯代正己烷, 1-甲基哌嗪, 2-羟基- 3-萘酸 (保定华新试剂有限公司); 1-(3-氨丙基)咪唑(日本TCI公司)。
采用化学共沉淀方式制备Fe3O4纳米粒子:(1)称取适量FeCl2· 4H2O、FeCl3· 6H2O溶于100 mL超纯水中, 加入2.0 mL油酸超声20 min, 然后倒入三口瓶中, 在600 rpm, 60 ℃下加入15 mL浓氨水, 温度升高至80 ℃, 再加入2.0 mL油酸, 熟化2 h。用强磁铁分离溶液中的Fe3O4纳米粒子, 反复用水和乙醇清洗干净后分散到100 mL水中。(2)将3.0 g聚乙烯吡咯烷酮在250 mL三口瓶中溶于120 mL水中; 在20 mL Fe3O4磁流体中, 加入1-甲基哌嗪2.0 mmol, 2-羟基-3-萘酸2.0 mmol, 1-(3-氨丙基)咪唑0.95 mL, 氯代正己烷1.4 mL, EDMA 9.4 mL, AIBN 200 mg, 超声分散均匀; 逐滴加入到三口瓶中; 通入氮气, 60 ℃水浴加热, 600 rpm搅拌下反应24 h。将得到的材料反复用甲醇和乙酸混合液(9:1, V/V)洗涤, 真空干燥, 并将其分散到100 mL乙醇中待用。
取0.25、0.5、1、3、5 ng标准9947A阳性DNA对照样本分别置于0.5 mL离心管中加入190μ L裂解液, 2μ L DTT, 4μ L磁珠, 涡旋混匀10 min后, 置于磁力架上分离磁珠与溶液。弃去上清液, 加入150μ L乙醇溶液震荡洗涤, 弃去洗涤液, 洗涤过程重复2次。将离心管置于65 ℃烘干, 待溶液彻底挥发, 加入20μ L超纯水, 混匀, 10 min后将离心管置于磁力架上, 吸取上清液, 用AmpFlSTR Identifiler试剂盒扩增。
剪取擦拭了凶器上血迹的棉签适量, 放入1.5 mL
样品管中, 加入200μ L磁珠裂解液, 10μ L蛋白酶K, 涡旋震荡混匀, 56 ℃孵育1 h; 离心, 取上清液加入20μ L磁珠, 充分混匀, 吸附10 min; 震荡混匀, 置于磁力架上, 去溶液, 加入400μ L洗涤液, 涡旋混匀, 放于磁力架上洗涤, 重复2次; 将样品管置于65 ℃加热块中烘干, 然后加入30μ L超纯水, 震荡混匀, 使DNA释放到超纯水中, 5 min后将样品管置于磁力架上, 吸出溶液, 将得到的DNA用AmpFlSTR Identifiler试剂盒扩增。
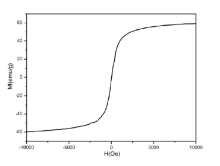
本文首次以离子液体为共聚单体, EDMA为交联剂, 磁流体为分散相, AIBN为引发剂, 成功制备出具有超顺磁性的复合磁性纳米粒子。该制备方法采用改进的一步悬浮聚合法, 将磁性纳米粒子的制备与表面修饰融合到一步, 较一般制备方法[7, 8, 9, 10]操作步骤更为简单。离子液体由于其具有极低的蒸汽压, 较高的热稳定性和可控的溶解能力而广泛应用于分离提纯领域。本文将离子液体经过聚合反应嫁接到磁性纳米粒子上, 可以大大提高该磁性纳米粒子的选择性提取能力以及热稳定性和酸碱适应能力。EDMA作为一种常用的聚合反应交联剂, 因其具有两端乙烯基的存在, 可使聚合反应得到的复合磁性纳米粒子的机械强度更高, 反应更为完全。悬浮聚合方法, 因其反应过程始终在高速搅拌下进行, 这使得反应物可以充分分散到介质中, 能获得比较单一的微球状粒子, 避免因表面张力而产生聚集。本文制备的离子液体复合磁性纳米粒子融汇了离子液体的稳定性、高选择性、酸碱适应性以及磁性纳米粒子的超顺磁性易于分离的特点, 可以有效提高DNA提取效率, 减少相类似的传统磁珠所需的应用条件。图1为磁性纳米粒子的透射电镜图, 从图中可以看出, 制备的磁性纳米粒子分散性良好, 粒径均小于20 nm; 用VSM测试磁性纳米粒子的磁滞回线(见图2), 表明该磁性粒子的磁滞回线为可逆单线, 显示该粒子具有较好的超顺磁性。
 | 图 1 离子液体复合磁性粒子的透射电镜图Fig.1 Transmission-electron microscopic image of ionic liquid composite magnetic nano-beads |
采用制备的离子液体复合磁性纳米粒子从含有0.25、0.5、1.0、3.0、5.0 ng标准9947A阳性DNA对照样本的190 µ L溶液中提取DNA, 并将测序结果与进口磁珠提取结果进行比较(见表1), 用自制粒子提取可在16个基因座获得正确分型, 仅对0.25 ng样本丢失部分基因座; 而用M48磁珠DNA提取试剂盒仅3、5 ng样本获得完整分型, 其余样本均丢失大部分基因座。这证明本文所制备离子液体复合磁性纳米粒子具备有离子液体的高提取效率, 其痕量DNA的提取效果优于普通磁珠。
| 表 1 不同磁珠法提取9947A阳性对照DNA样本获得的基因座数量比较 Table 1 Amount of STR Loci obtained from 9947A DNA standard sample extracted with homemade and M48 magnetic-beads |
用自制离子液体复合磁性纳米粒子从凶器血迹中提取DNA, 在 16个基因座均获得了正确的分型。基因座峰高、峰面积较均衡, 单个峰对称性也较高。
综上所述, 本研究制备的纳米级离子液体复合磁性粒子汇合了离子液体提取、纯化效率高以及纳米材料固有的比表面积大、分散性好等优点, 其微量DNA提取能力优于进口磁珠。该离子液体复合磁性粒子制备过程简单、快速, 价格低廉。后续研究将进一步优化复合磁性粒子制备条件, 进一步提高提取性能, 优化痕量DNA的提取过程, 争取使其适用于更多种类的生物检材、特别是微量及腐败检材。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|