作者简介:丰蕾(1984—),女,山西人,副主任法医师,博士,主要从事法医遗传学方面研究工作。Tel:010-66269473; E-mail:fengelink@163.com
目的 研究PCR产物纯化对微量DNA的STR分型的影响。方法 使用25pg/μL的9947标准基因组DNA为模板,标准程序扩增和STR分型检测。设立对照组A和实验组B、C、D。实验组分别使用分子筛(Qiagen DyeEX2.0 spin kit)、超滤膜(Amicon Ultra-0.5,100KD)、亲和层析(Qiagen MinElute Column)3种DNA纯化方法,对照组不做任何处理。结果 与对照组相比,3种方法均可显著提高STR分型强度( P峰高<0.001),平均峰高约为对照组的4倍,并且3种方法对提高STR分型强度无显著差异( P峰高=0.249)。结论 PCR产物纯化能显著提高微量DNA的STR分型强度,可用于骨骼、脱落细胞等微量DNA检材的检验。
Objective This paper investigated the enhancement of STR profiles peak intensity using post-PCR purification, as it becomes increasingly important to gain DNA profile information from exceedingly trace levels of DNA. Methods The 9947 genome of 25pg/μl concentration was used as DNA template for STR profiling. The PCR product was divided into control group and three examined groups. The control group was electrophoresed as standard procedure, and in examined groups, PCR products were purified using molecule sieve method (Qiagen DyeEX2.0 spin kit),ultrafiltration method (Amicon Ultra-0.5,100KD) and affinity chromatography method (Qiagen MinElute Column) separately before electrophoresis. Results In three examined groups, an approximately 4-fold increase in STR peak height (RFU) was observed relative to the standard conditions, while there is no significant peak height difference between three groups. Conclusions Post-PCR purification is an alternative tool for enhancing STR peak height and would be used in forensic casework.
随着DNA技术的发展和物证提取意识的增强, 微量生物检材的STR检验在案件鉴定中发挥着越来越重要的作用[1]。然而, 微量生物检材往往获得的DNA模板量少, 在PCR扩增时, 由于随机扩增效应等因素的影响, 致使出现峰值低、缺带、多带、异常高的sttuter峰以及杂合子不平衡等一系列现象[2], 难以获得高质量的STR分型。在实际的案件检验中, 针对微量DNA的检验, 经常采用增加模板量、循环次数以及多次扩增的方法来提高STR分型的准确性和检出率[3]。使用PCR产物纯化的方法在实际案例中却很少使用, 本文系统地比较了分子筛、超滤膜膜亲和吸附3种方法对PCR产物纯化, 发现PCR后纯化显著提高了STR分型的强度, 可有效改善微量DNA的检验结果。
采用DNA TyperTM15复合扩增试剂盒中9947标准基因组DNA为模板, 稀释浓度为25pg/μ L备用。
采用DNA TyperTM15复合扩增试剂盒, 标准25μ L PCR扩增体系, 添加9947模板2.5μ L, AB公司GeneAmp PCR system 9700扩增仪平行扩增20管, 并且设立阴性和阳性对照。扩增后每2管PCR产物合并为1管并且混合均匀, 共形成10个样品, 每个样品分装为4份, 每份10μ L, 分别编为A组、B组、C组和D组。
A组不做任何处理; B组按照Qiagen DyeEX2.0 spin kit纯化, 最终体积约10μ L; C组采用Amicon Ultra-0.5, 100KD超滤管, 500μ L去离子水稀释后, 浓缩到10μ L; D组采用Qiagen MinElute Column 纯化, 最终洗脱体积为10μ L。
未纯化的A组与纯化后的B组、C组和D组的PCR扩增产物分别加10μ L甲酰胺溶液(其中含5%的内标), 在AB 3500xl型遗传分析仪上检测, GeneMapper ID-X软件分析结果。采用SPSS软件对STR分型数据进行统计学分析。
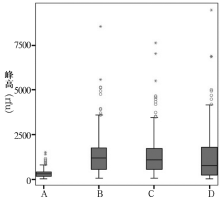
使用分子筛(Qiagen DyeEX2.0 spin kit)、超滤膜(Amicon Ultra-0.5, 100KD超滤管)、亲和吸附(Qiagen MinElute Column)3种方法对标准PCR扩增产物纯化后检测, 与未纯化的对照组进行比较。为降低随机因素误差, 统计10次独立重复试验结果, 计算STR峰高和峰面积的平均值。与A组(对照组)相比, B组(分子筛)、C组(超滤管)和D组(亲和吸附)后的峰高均显著提高, 分别为A组的4.2、4.1、3.7倍, 平均峰面积为A组的4.5、4.2、4.0倍; 同时, 检出率也有所提高, 缺峰个数也相应减少, 从A组的10次试验中缺少3个等位基因峰, 减少为纯化后的0个缺失或者只缺少1个(见表1)。
| 表1 A组、B组、C组和D组峰数、峰高和峰面积统计 |
A组、B组、C组和D组的10次试验结果峰高分布图(见图1)显示4组峰高分布范围跨度很大, 而且纯化组(B、C、D组)峰高显著高于对照组(A组)(见图2)。为比较处理组与对照组的峰高和峰面积差异, 采用单因素方差分析检验差异显著性。A组与B组、C组、D组间有显著差异(P峰高< 0.001, P峰面积< 0.001), 而B组、C组和D组3组检验无显著差异(P峰高=0.249, P峰面积=0.358), 这一结果显示差异主要来源于A组即对照组, 采用3种方法处理均可显著提高峰高强度。
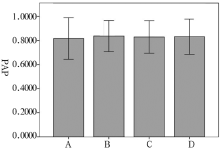
杂合子峰高不平衡是微量DNA扩增常遇到的问题, 它可以通过等位基因两个峰面积比(PAR)来衡量, PAR等于小峰面积除以大峰面积, 因此PAR≤ 1。通过计算发现, A组、B组、C组和D组平均PAR并无明显差异, 均在0.8左右(见图3)。
随着DNA检验技术在实际案件中的普遍应用, 越来越多地遇到微量DNA检验鉴定。微量生物检材包括清洗过的衣物、陈旧骨骼等, 往往是案件关键的物证。通常低于100pg的模板DNA称为低拷贝数DNA(LCN), 1个人体细胞核基因组约6pg, LCN约只有16个细胞的DNA量[4]。目前解决LCN分型的主要方法分为3类:PCR前处理, PCR中处理以及PCR后处理。其中PCR前处理包括:采用磁珠法提取纯化模板DNA, 去除扩增抑制物; 增加模板量等。PCR中处理包括:增加PCR循环次数, 从标准的28个循环增加到30个循环; 减小扩增体系, 间接提高模板浓度等。PCR后处理包括:延长遗传分析仪进样时间, 以增加PCR产物进样量; 增加上样量、调整上样电压、使用低渗的高质量甲酰胺等方法改善电泳质量等方法[5]。
本文探讨的PCR产物纯化属于PCR后处理。STR毛细管电泳为电进样, PCR扩增产物溶液中不仅包含目的基因座位点扩增片段, 而且还包含引物、dNTP、缓冲液中各种盐离子、DNA聚合酶等物质, 这些物质与扩增产物会相互竞争进入毛细管。因此如果能去除这些物质对扩增产物的干扰, 增加实际目的扩增产物电泳进样量, 从而在不改变PCR扩增条件的情况下, 达到增强STR分型峰高强度的目的。本文发现纯化PCR产物可以增强STR分型峰强度约4倍, 同时增加检出率, 由于PCR产物纯化后再上样检测的方法能够起到放大的作用, 使一些按正常步骤电泳的样品不能观察到的荧光峰, 在采用该方法后能被观察识别, 提高了STR分型质量。
本实验比较的3种PCR产物纯化方法在操作复杂程度方面, 超滤膜法操作最为简洁, 只需一步操作后离心, 亲和吸附法操作最为繁琐。在耗时方面, 分子筛法最为省时。从成本上看, 平均每个样品的成本相差不大。由于是直接对PCR产物操作, 因此需要更加注意防范污染, 要严格按照DNA实验室的污染和防范标准操作[6]。
Luke等人比较了亲和柱方法进行PCR产物纯化和增加循环数这两种方法对于STR峰高的影响, 与增加循环数相比, PCR产物纯化可以显著增强峰高, 而且不会引入更多的其他杂峰[7]。本文作者也将该方法应用到实际案例中, 使用超滤膜的方法对7例骨骼检材和6例常规脱落细胞检材的PCR产物进行纯化, 发现STR分型强度和检出率都显著提高[8]。因此, 影响微量DNA尤其是接触DNA检验成功率的因素很多[9], PCR产物纯化作为一种有效改善微量DNA的STR分型强度的方法, 将在实际DNA案件检验中发挥重要的作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|