作者简介:黄军磊(1988—),男,河南唐河人,在读硕士,从事法医遗传学方面研究。Tel:18010196564
目的为了克服传统PCR热循环仪体积大,运行电压高,耗时长,只能在实验室中应用的缺点,研究了一种微腔型 PCR 芯片,以期实现现场对STR片段的复合扩增。方法采用在PCR反应缓冲液中加入不同浓度的BSA溶液对芯片进行表面优化处理的方法及不同酶量优化实现对STR片段的有效扩增。结果使用浓度为0.5mg/mL的BSA可得到清晰完整的STR分型结果;加大酶量有益于扩增效率的提高。结论该种微腔型PCR芯片经初步优化后可有效地对STR片段进行复合扩增,经进一步优化可真正实现法医DNA分析的更加微量化和快速化。
Objective To develop a rapid method for DNA analysis by using micro-cavity PCR chip. Methods By adding different concentrations of BSA solution and TaqGold polymerase in the PCR reaction buffer,the surface of the chip was optimized to achieve efficient amplification of the STR fragments. Results Complete STR genotyping results were obtained with a concentration of 0.5mg/ml of BSA. Conclusion The optimized micro-cavity PCR chip was effective for multiplex amplification of STR fragments, and it is possible to achieve a rapid forensic DNA analysis at the crime scene through further optimization.
聚合酶链反应( PCR) 是一种选择性体外扩增 DNA 片段的方法, 广泛应用于分子生物学的各个领域。利用微加工技术制备的微型PCR芯片以其体积小, 升降温速度快和消耗试剂少等优势已成为当前研究的热点[1] 。本研究用一种基于NOA81光胶的微腔型PCR芯片初步实现了STR片段的复合扩增, 报道如下。
AmpFlSTR ® Identifiler PCR 扩增试剂盒(美国AB公司)、9700 型热循环仪(美国AB公司)、3130XL型遗传分析仪(美国AB公司)、牛血清蛋白(BSA)(北京拜尔迪生物技术公司)、基于NOA81光胶的微腔型PCR芯片及加热温控装置(北京理工大学生命学院), 见图1。
用AmpFlSTR ® Identifiler PCR 扩增试剂盒进行DNA扩增, 对照试验用9700型热循环仪进行扩增, 其余各组在0.2mL PCR管内配制反应混合液后取5μ L加入芯片反应腔内, 配比如表1所示。PCR芯片用紫外光胶封口后连接控制装置, 加热电压6.9v, 温感器电压4.9v。扩增程序均为:95℃ 11min; 94℃ 1min, 59℃ 1min, 72℃ 1min, 29个循环; 60℃延伸60min。所有产物均在3130XL型遗传分析仪上按照标准操作规则进行检测, 用GenMapper IDv3.2软件进行数据分析。每组试验重复5次。
| 表1 实验分组及反应液配比 |
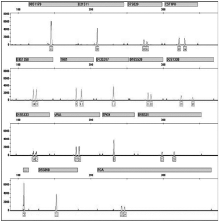
芯片常规组反应混合液中未加任何表面改性剂, 相当于把传统的PCR体系缩小移植到芯片上, 结果仅有个别位点得到有效扩增, 且峰值很低(见图2); 10μ L体系的常规对照结果正常(见图3)。制作芯片反应腔的材料是NOA81紫外固化型光胶, 目前未见其对PCR影响的相关报道。从这组的结果可以看出其固化后的表面化学性质对PCR反应会产生抑制作用。
芯片上的PCR扩增与传统的PCR扩增不同。由于体积的缩小, 芯片的比表面积变大, 表面作用更为明显, 表面修饰处理显得更为重要[3]。BSA是常用来进行芯片通道表面的动态改性试剂, 一定浓度的BSA可以与Taq DNA 聚合酶等形成竞争性吸附, 而且能够被优先吸附到微通道的表面上, 从而减少其对Taq DNA 聚合酶的吸附, 同时也避免了PCR混合液中其它组分在微通道表面的非特异性吸附[2]。本研究采用在PCR反应混合液中添加与DNA等比的BSA溶液的方法进行芯片反应腔内表面的动态改性。实验发现, 当BSA溶液浓度小于0.25mg/mL时, 达不到对通道内表面处理的效果; 大于1.5mg/mL时效果也不好, 原因可能是过高的蛋白浓度会对PCR反应有抑制作用, 故选用浓度为0.25、0.5、1.0、1.5mg/mL的BSA进行优化处理。结果表明:加入BSA溶度为0.5mg/mL时得到完整的STR分型(见图4), 其余三个浓度在D7S820、D2S1338、D19S433、D18S51和FGA这5个位点均有不同程度的缺失或(和)峰值过低。用浓度0.5mg/mL的BSA优化处理得到的完整STR分型, 但与常规对照相比仍有峰值较低、位点平衡度不高及非模板加A不完全等方面的问题。
经过BSA对反应腔内壁封闭处理后, 在一定程度上大大减少了内壁对Taq聚合酶的吸附, 同时也起到稳定Taq聚合酶的目的。在采用浓度0.5mg/mL的BSA优化的同时加大反应液中的酶量对扩增效率仍有一定影响。在同一芯片的不同通道的PCR反应液中分别加入0.5、1、1.5、2 U的Taq聚合酶, 扩增后电泳检测结果对比发现, 加大酶量所得STR图的位点峰值均有不同程度的提高, 扩增效率得到提高。加入1.5和2 U的酶效果相近(见图5)。这是因为, 虽然内壁经过了一定的表面修饰处理, 但内壁对酶或者其他成分仍有一定的吸附或者抑制其活性。因此, 在吸附饱和前, 适当加大酶量, 可以增加酶的活性, 但当达到饱和吸附后, 增加酶量对提高扩增效率已没有显著效果[3]。
本研究采用一种新型的NOA81光胶PCR芯片对STR片段进行复合扩增, 获得的STR分型结果清晰、完整。通过优化对比扩增发现:一定浓度的BSA表面处理剂与适当增加酶量可提高扩增效率。虽然与常规9700型热循环仪的扩增效果相比, PCR芯片在扩增效率、平衡性及稳定性等方面与还略有不足, 但9700体积大, 耗时长(完成扩增需近3h), 而该套芯片装置体积小, 运行所需电压小(仅6.9v), 可利用车载电源在现场进行分析以便实现现场便携化, 且消耗试剂少、耗时较短(完成扩增花费2.5h)。后续的研究会对芯片及配套检测试剂进行优化, 进一步降低扩增体系和缩短扩增时间, 并对现场各类型样本进行有效性、稳定性和灵敏性的验证研究, 以期实现真正的现场便携化和快速化。
The authors have declared that no competing interests exist.