作者简介:黄健(1987—),男,满族,内蒙古人,在读硕士,主要从事毒物检测方面的学习研究。Tel:15304708769; Email:huangjian_wx2010@hotmail.com
目的建立超高效液相色谱串联质谱法(UPLC-MS/MS)测定全血中林可霉素的方法。方法样品血使用3mL水提取,涡旋离心,上清液过HLB柱,用10%甲醇溶液淋洗,甲醇洗脱,洗脱液用于UPLC-MS/MS分析。采用ACQUITY UPLC® HSS T3 色谱柱分离,采用电喷雾多反应监测模式(MRM)检测。结果以林可霉素母离子406.987(m/z)和子离子126.011及359.009(m/z)定性、定量。加标回收率在104.98%~120.74%。在S/N≥3的情况下,最低检出限为55.4pg/mL。结论本方法分析速度快,灵敏度高,准确度高,重现性好,可在法庭科学应用推广。
Objective To study an analytical method for determination of lincomycin in blood.Methods The samples were extracted by SPE and then analyzed by HPLC with ACQUITY UPLC® HSS T3 column and electron spray ionization.Results Average recovery rate of lincomycin ranged from 104.98 to 120.74%. Based on a signal-to-noise ratio of 3∶1, the detection limit was 55.4 pg/ ml.Conclusion This method is sensitive, accurate and can be used in casework.
林可霉素作为一种常见的抗生素, 在中国使用的范围很广, 使用量也很大, 人体摄入过多时会出现致敏性、毒性等不良症状[1]。本文使用固相萃取法对样品进行前处理, UPLC-MS/MS进行检测。UPLC-MS/MS是HPLC-MS/MS的发展与革新, 分析速度快, 灵敏度高, 将其应用于生物检材中抗生素类药物的检测, 将大大提高抗生素类药物在中毒、死亡案件中的检出率, 为案件的侦破和法庭诉讼提供科学依据[2, 3]。
抗生素类药物致人中毒、死亡与常见药物不同, 由于给药途径、药物配方禁忌等原因, 很小剂量的抗生素就可能引起中毒、死亡。目前涉及刑事案件的抗生素中毒、死亡案件主要是由非法行医引起的, 且此类案件的数量有增多趋势。本文针对常见的抗生素药物引起的中毒、死亡案件进行检验鉴定方法的研究, 报道如下。
Acquity超高效液相色谱仪— Xevo TQ 质谱仪(美国Waters公司), SORVALL®高速离心机(美国SORVALL公司), Cole-Parmer超声波清洗器, Vortex Genie-2 涡旋混合器(美国Scientific Industries公司), Satorius 电子分析天平(德国Satorius公司 ), Millpore Simplicity纯水制备系统
乙腈、甲醇、二氯甲烷、乙酸乙酯为色谱纯试剂, 林可霉素标准品(德国Dr. E实验室), Oasis®HLB与Bond ElutC18固相萃取柱(美国Waters公司)。
精确称取10mg林可霉素标准品用甲醇定容至100mL, 摇匀, 配成0.1mg/mL 标准溶液, 于 -20℃冰箱中冷冻避光保存。精密吸取标准溶液用甲醇逐级稀释成1μ g/mL、500ng/mL、100ng/mL、10ng/mL, 1ng/mL待用。
1.4.1 色谱条件 色谱柱ACQUITY UPLC® HSS T3 (2.1mm× 50mm× 1.8μ m); 流动相(A)甲醇, (B)0.1%甲酸水溶液; 柱温35℃; 进样量3μ L; 流速0.6mL/min。梯度洗脱0min~1.5min, 10%~40%A; 1.5min~1.8min, 40%A~90%A; 1.8min~2.2min, 90%A; 2.2min~2.5min, 90%~10%A; 2.5min~4.5min, 10%A。
1.4.2 质谱条件 三重四级杆正离子模式(ESI+); 毛细管电压3.20kV; 离子源温度150℃; 脱溶剂气温度400℃; 脱溶剂气流量800L/hr; 锥孔气流量50L/hr; 采用多反应监测模式(MRM), 林可霉素优化采集参数见表1。
| 表1 林可霉素的MRM条件 |
1.5.1 固相萃取法 取0.5mL检材血, 以3mL去离子水稀释, 涡旋30s, 振荡15min混匀, 8000r/min 离心30min。Oasis® HLB(30μ m) 柱依次经3mL 甲醇, 3mL 去离子水活化。取离心样品上清液过HLB柱, 用3mL 10%的甲醇溶液淋洗杂质, 弃去, 精密吸取3mL甲醇洗脱。洗脱液涡旋混合, 0.22μ m微孔滤膜过滤, 装入小瓶待测。
1.5.2 液液萃取法 取0.5mL检材血, 加入硼酸-硼砂缓冲溶液至pH=9, 加入4mL乙酸乙酯, 涡旋30s, 振荡15min混匀, 8000r/ min 离心30min。转移上清液至试管中, 吹干, 用1mL甲醇定容, 0.22 μ m微孔滤膜过滤, 装入小瓶待测。
1.5.3 沉淀蛋白法 取0.5mL检材血, 加入2mL甲醇, 涡旋30s, 振荡15min混匀, 8000r/min 离心30min, 取上清液经0.22μ m微孔滤膜过滤, 装入小瓶待测。
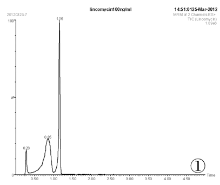
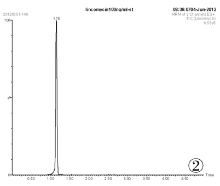
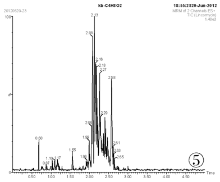
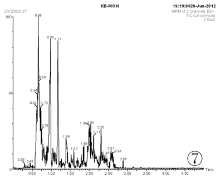
分别采用甲醇和乙腈配制标准样品并稀释至100ng/mL, 装瓶进行检测。所得色谱图见图1、图2。由图1和图2可知, 以乙腈作为溶剂有杂峰, 因此选择甲醇做溶剂配制标准样品。
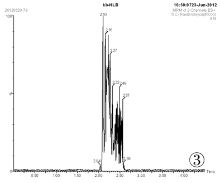
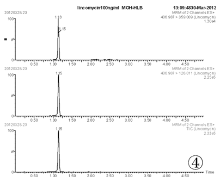
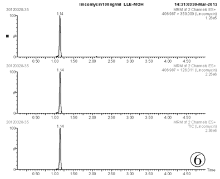
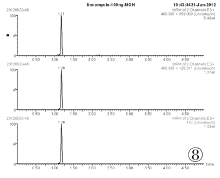
取空白血0.5mL, 按照“ 1.5样品前处理” 的步骤进行处理, 采用MRM模式得到空白血的离子色谱图(见图3、图5、图7)。取1μ g/mL林可霉素对照品溶液100μ L加入到空白全血中, 同法操作得到100ng目标物血添加的离子色谱图(见图4、图6、图8)。结果表明, 全血中内源性物质对林可霉素的测定不产生干扰。
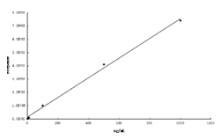
在设定的色谱条件下, 分别对一系列标准溶液进行分析, 以林可霉素的浓度为横坐标, 以林可霉素的峰面积为纵坐标建立线性回归方程:
y=781.818x+683.15, R2=0.9925. 线性范围是1ng/mL~1μ g/mL。由此可得出仪器运行环境良好, 标准品可用(见图9)。
分别对3种前处理方法制得的标准溶液进行分析, 以林可霉素的浓度为横坐标, 以林可霉素的检出峰面积为纵坐标, 进行线性回归得以下线性回归方程:
固相萃取:y=1176.75x+81.921, R2=0.9986
液液萃取:y=781.818x+683.15, R2=0.9986
沉淀蛋白:y=942.828x+1393.68, R2=0.9938
本实验比较在液液萃取是调节pH值和不调节pH值, 结果显示当pH=9时, 液液萃取的回收率有所提高, 但依旧不能达到80%。液液萃取所用的有机溶剂量多, 耗时长。沉淀蛋白法操作简便快速, 但在低浓度样品的检测时回收率不高。固相萃取法在低浓度样品的检测中有更好的回收率, 考虑案件中多数检材含量较低, 固相萃取法更符合办案需要, 因此选择固相萃取法作为前处理方法。
本实验比较了Oasis® R HLB、Bond ElutC18和Oasis® R WCX小柱的净化效果, 发现Bond ElutC18柱对林可霉素吸附能力不强, 目标物在过柱过程中有大量流失, 吸附在柱子上的目标物很少, 导致回收率非常低; 而Oasis® RWCX和Oasis® R HLB柱则具有良好的吸附能力和净化效果, 在过柱过程中几乎没有流失, 但是Oasis® R WCX柱需要调节pH值操作更繁琐, 因此本实验选择Oasis® RHLB柱对样品进行富集和净化。
流动相中缓冲盐的种类、浓度及pH值不仅会影响目标化合物的保留时间及峰形, 还会影响其离子化效率, 从而影响检测灵敏度。实验分别考察了乙腈-水/甲酸铵、乙腈-水/甲酸、甲醇-水/甲酸铵、甲醇-水/甲酸体系作为流动相的情况, 甲酸铵浓度5mmol/L甲酸的浓度为0.1%。结果表明, 甲醇-水/甲酸作为流动相时, 林可霉素的响应最高, 峰形对称。因此, 最终选择甲醇-水/甲酸体系作为流动相。
取空白血0.5mL, 添加标准溶液质量分别为10ng、50ng、100ng。按照“ 1.5.1样品前处理” 的方法提取后进样测定, 得出实测浓度范围为3.3ng/mL~33.3ng/mL。每天每个浓度平行做3个, 连续做3天。分别求得日内、日间精密度, 结果见表2。本实验中, 以S/N≥ 3作为检出限, 林可霉素最低检测限55.4pg/mL, 以S/N≥ 10作为最低定量限, 最低定量限0.183ng/mL, 可以满足办案需求。
| 表2 空白血中林可霉素标准添加回收率和精密度 |
目前, 对抗生素的分析主要集中在环境检测和食品安全检测中, 其中对于动物源性的食品检测[4, 5]对法庭科学中人体检材的净化和分析有一定的借鉴作用, 但是对血液的检测研究较少。本实验建立了固相萃取-超高效液相色谱串联质谱法测定全血中的林可霉素的方法, 分析速度快, 灵敏度高, 准确度高, 重现性好, 可在法庭科学应用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|