作者简介:郝金萍(1978—),女,山西人,硕士研究生,主要从事法医物证检案及科学研究工作。Tel:13146627703; E-mail:hao-haoaho@163.com
目的探讨并比较茚三酮显现汗潜指印的3种操作方法,即溶液浸泡法、涂抹法和喷雾法对后续DNA检测带来的影响。方法取16名志愿者的指印分4组,分为茚三酮浸泡法、涂抹法和喷雾法以及空白组,然后提取DNA进行定量和STR分型检测。结果3种操作方法都会减少汗潜指印DNA的量,喷雾法的损失量最大,浸泡法和涂抹法结果比较接近。结论现场可疑指印检材,应根据检验需要决定指印显现和DNA提取的先后顺序。
Objective To investigate the effect of ninhydrin development of fingerprint on subsequent DNA profiling.Methods Each of 16 volunteers were asked to deposit four thumb fingerprints on envelopes with firm pressure for 30 seconds. These prints were divided into 4 sets. The Three sets were developed by ninhydrin with different operational method, one method is dipping, one method is smearing, and one method is spraying. The last set was untreated with ninhydrin reagent, and then, all prints were processed for DNA quantification and profiling.Results The DNA quantity on the three sets of prints treated by ninhydrin was all reduced compared to those untreated prints, of which spraying was most, dipping and smearing were approximately equal.Conclusion These three ninhydrin operational methods could all reduce DNA quantity and thus interfere with subsequent DNA profiling. So in casework, the sequence of two processes, DNA extracting or fingerprint development, should be decided first.
尽管汗潜指印DNA检测成功率因个体的差异而参差有别, 且远不如指印显现技术的成功率高, 但是, 对于那些模糊﹑残缺或是缺少细节特征不具备指纹检验的指印, 已显现汗潜指印的DNA检测从生物遗传学角度赋予了它们证据价值, 从而服务于破案和诉讼。
影响已显现汗潜指印DNA检测的因素有很多:显现试剂会阻碍DNA的提取[1], 或者显现过程中某特殊光源的照射会减损DNA物质[2], 亦或显现操作手法会对DNA检测带来污染和损失[3]。本研究比较了茚三酮显现法中3种常用操作方法, 即溶液浸泡法、涂抹法和喷雾法显现汗潜指印对后续DNA检测带来的影响。
茚三酮显现试剂、喷雾瓶、玻璃皿、脱脂棉、镊子, QIAGEN MagAttract® DNA Mini M48 试剂盒(QIAGEN公司, 美国), Quantifiler® Human DNA Quantification定量试剂盒(AB公司, 美国), AMPFlSTR® Identifiler试剂盒(AB公司, 美国), 7500型荧光定量PCR仪(AB公司, 美国), 9700型PCR扩增仪(AB公司, 美国), 3130XL型遗传分析仪(AB公司, 美国)。
16名志愿者(A、B、C、D……P)用左右手大拇指在牛皮纸上的指定位置进行对称捺印30秒, 捺印力度控制在1500g左右, 将这两枚指印分别标为A-1, A-2, B-1, B-2……P-1, P-2。1小时后再对称捺印两枚拇指印, 分别标为A-3, A-4, B-3, B-4……P-3, P-4。将A-1, B-1, C-1……编为一组, A-2, B-2, C-2……编为二组, A-3, B-3, C-3……编为三组, A-4, B-4, C-4……编为四组。
由于在之前的研究中曾比较了牛皮纸、报纸、复印纸、白卡纸上手印DNA, 结果发现牛皮纸上手印DNA更容易保存并提取, 因此本实验手印载体选用牛皮纸。
1.3.1 溶液浸泡法 将第一组样品浸泡于装有茚三酮溶液的玻璃皿中, 用镊子夹取边缘轻轻晃动使其浸润均匀, 待纸片浸透取出晾干。
1.3.2 涂抹法 用镊子夹取一小团脱脂棉蘸取茚三酮溶液, 轻轻均匀地涂抹在第二组样品的待显物面上, 晾干。
1.3.3 喷雾法 将茚三酮显现试剂灌注到喷雾瓶中, 将喷口对准第三组样品的待显物面距离30~50cm进行喷洒。
1.3.4 空白对照 第四组检材不作任何处理。
用剪刀将各张牛皮纸的指印部位剪取下来, 分别剪碎置于1.5mL的离心管中; 加入400~500μ L缓冲液G2, 10μ L蛋白酶K, 56℃孵育3h左右。然后套管离心, 取上清液。以“ MTL∶ 样品溶液=3∶ 1的体积比” 加入结合液MTL, 再加入磁珠30μ L, 充分混合溶液, 吸附大约15min 。将离心管置于磁力架上, 上下颠倒数次, 吸出溶液, 加入500μ L MW1溶液, 摇匀, 吸出溶液; 加入500μ L 80%乙醇溶液, 摇匀, 吸出溶液, 重复3次; 打开管盖, 放在烘干机上烘干; 加入40μ L去离子水, 加热10min, 高速漩涡震荡2s, 迅速将其置于磁力架上, 吸出溶液。
用Quantifiler® Human DNA Quantification试剂盒, 采用10μ L 体系, 对DNA提取液进行DNA定量。其中Reaction Mix 6.25ul, Primer Mix5.25μ L, 标准品及样品DNA各1μ L , 采用7500型荧光定量PCR仪, 反应条件为:95℃10min; 95℃16s, 共40个循环; 60℃延伸1min。
采用AB公司的Identifiler®试剂盒, 在9700型扩增仪上进行PCR反应, 扩增条件是:95℃11min, 94℃1min, 59℃1min, 72℃1min, 共32个循环, 最后60℃延伸60min。
扩增产物经3130XL遗传分析仪检测, 用GeneMapper ID v3.2软件进行STR分型。电泳条件按说明书进行。
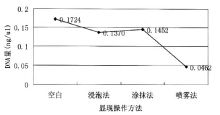
记录所有志愿者每枚汗潜指印中所提取的DNA量, 求取每组指印DNA量的平均值并做曲线图(见图1), 空白对照组指印DNA量最多, 喷雾组指印DNA量最少, 浸泡组和涂抹组指印DNA量相差无几。
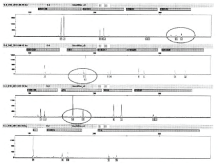
空白对照组的16名志愿者的指印DNA的量从0.0133~1.41ng/μ L不等, 有研究表明[4], 不同个体能够提取到的指(掌)印DNA量存在很大差异。Gill等认为[5], 当DNA模板量少于100pg时即为低拷贝模板(LCN)。LCN的STR分型由于模板量少, 会产生不对称扩增、等位基因丢失或增加、影子带增强等问题[6]。而指印DNA多数为LCN, 本研究中所获得的指印DNA-STR即出现了上述问题(见图2)。为了提高指印DNA-STR分型检验的灵敏度[6], 本次研究通过增加PCR循环数, 在空白对照组中的6份手印DNA样本获得了分型准确的STR分型图谱, 其经过3种操作方法显现手印后, DNA分型图谱峰高都有所降低。
无论用何种溶液显现操作手法, 显现后的指印DNA量相较于未显现的都发生了减损。浸泡法要求将纸张沉浸在显现试剂中, 并不时用镊子拖动它使之反应更加彻底, 而这个晃动过程则极易使脱落细胞脱离纸张, 遗留在溶液中; 涂抹法中所使用的脱脂棉团在轻轻擦拭的过程中则容易将纸面上的脱落细胞沾附走; 而喷雾法中喷壶口在对纸面喷洒时, 虽然不直接接触, 但是在喷溅过程中其较强的冲击力就可将纸张上的脱落细胞冲离纸面。
通过实验可发现, 经喷雾法显现的汗潜指印中所含DNA量少于由另外两种方法显现的指印所含DNA量。尽管3种显现操作方法或浸泡晃荡或涂抹沾附抑或强大冲击波的冲击都会对纸张上脱落细胞量带来减损, 但是从最终结果上来看, 浸泡和涂抹所带来的损失都较小, 且不相上下, 而相较于前两者, 喷雾法则会导致较大的损失, 同时对显现后汗潜指印的DNA检测也会产生较大的影响。
尽管汗潜指印经过显现后其DNA量均减少了, 但是通过与空白样本比较, 差异显著性都不强。笔者怀疑这可能与实验的捺印载体相关。纸张一般由纸浆、填料、色料和胶料组成, 手印遗留后, 可溶性物质会渗入进纸张表面, 水分蒸发后, 氨基酸等物质就会与纸张纤维相结合, 而遗留在纸张表面的皮肤脱落细胞则由于纸张表面的粗糙不平不易因风吹、振动等因素而流失, 甚至可能因为纸面的疏松而进入纸张表面层, 从而在正常环境下保留较长时间。此外, 差异性不够明显也有可能与牛皮纸本身的成分有关。Jonathan Sewell[7]等人曾用同一试剂盒对报纸、杂志纸、滤纸、普通办公纸及白色卡片上的指印进行DNA提取检测, 结果显示, 报纸、杂志纸、滤纸上指印DNA能获得较好的回收提取, 但是普通办公纸和白色卡片上指印DNA的提取量较少, 扩增检测结果也较差。究其原因可能是后两者中含较大量的增白剂。显然地, 实验所用牛皮纸中基本不含增白剂, 而据研究显示, 制作大多数纸张时所使用的增白剂会扰乱DNA提取及后续的扩增。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|