作者简介:朱传红(1968— ),男,汉族,武汉市人,主任法医师,法医学博士,主要从事法医分子生物学研究、法医现场勘查学检验及研究。Tel:027-85395180;E-mail:zhuchh027@sina.com
目的 探讨联苯胺血痕预试验处理后样本DNA含量的变化及对STR分型检测的影响。方法 选取10名无关个体EDTA抗凝血液制成滤纸血痕,保存干燥时间分0.5h、1h、3h、6h、12h、24h 六个实验组,并采用磁珠提取法、QIAcube DNA提取纯化法、chelex-100提取法提取样本DNA,应用RT-PCR定量技术检测样本DNA含量,同时应用PCR-STR技术和Idfiler-plus试剂盒检测相应样本STR分型。结果 联苯胺血痕预试验后处理样本,随保存时间的延长,其样本DNA含量显示逐渐降低的趋势。回归线性对数分析显示,磁珠提取法:Y=-0.4087ln(x)+0.7044 R2=0.7633;QIAcube DNA提取纯化法:Y=-0.2393ln(x)+0.4764 R2=0.8715;chelex-100提取法:Y=-0.1178ln(x)+0.2302 R2=0.9571。不同DNA提取方法对同一保存时间的联苯胺血痕预试验试剂处理样本DNA含量间差异有极显著性, P<0.01。结论 联苯胺血痕预试验后对后续STR分型影响较大,联苯胺血痕预实验后的血痕不能继续进行STR分型检测。
Objective To investigate DNA analysis and DNA quantification of samples treated with the agents of benzidine tests.Methods Bloods of ten peoples were collected, and bloodstains were made on the filter paper. The same size and amount bloodstains were made by BSD600-DUET Paper Hole Puncher. Six experimental groups are divided by samples for 30min, 1h, 3h, 6h, 12h and 24h after samples treated with benzidine. Template DNA of samples were extracted by three DNA extraction methods(magnetic bead-based DNA extraction protocol,QIAamp DNA Investigator Kit protocol and Chelex-100 extraction).STR profiling was detected by PCR. DNA quantification of samples treatment was detected by real time PCR.Results The average values of DNA quantification of samples were decreased continuously with times after treatment with benzidine. The linear curves is Y=-0.4087ln(x)+0.7044(R2=0.7633)for the group of magnetic bead-based DNA extraction protocol),Y=-0.2393ln(x)+0.4764(R2=0.8715)for the group of QIAamp DNA Investigator Kit protocol, Y=-0.1178ln(x)+0.2302(R2=0.9571)for the group of Chelex-100 extraction. Statistical comparisons between each of the groups were made by multiple-ways Analysis of variance with SPSS 19.0 indicated that benzidine can alter DNA amount over time up to 24h( P<0.01), and that DNA amount with different DNA extraction methods have significant differences( P<0.01). DNA typing of 16 locis of 8.33% samples was detected by PCR-STR with Identifiler plus kits and the loss of 232 heterozygosity were detected in 142 samples.Conclusion Benzidine test has significant influence on DNA typing and DNA quantification, so the samples treated by benzidine could not be detected by PCR-STR.
联苯胺血痕预试验是刑事案件现场可疑血痕筛选的首选实验方法[1, 2, 3], 它具有灵敏度高、结果明了等优点, 特别是对稀释后血痕、清洁后微量血痕及在深色载体上的可疑血痕的筛选是重要检验方法之一[4]。血痕预实验后试剂对可疑血痕样本DNA检测的影响是近几年国外学者研究的重点[4, 5, 6], 国内尚未见报道。为进一步评价联苯胺预试验在法医学中的应用价值, 本文应用不同DNA提取方法、RT-PCR定量技术和PCR-STR荧光检测法, 对联苯胺血痕预试验后处理样本进行DNA含量变化研究及STR分型检测, 报道如下:
10名健康无关个体EDTA抗凝血样, 每份5mL, 由武汉同济医院血库提供, 分别制成滤纸血痕。采用BSD-600型半自动血样打孔器, 每份血痕制作等大圆形(1.2mm/片)血痕片各240片。
10名健康无关个体EDTA抗凝血样(由武汉同济医院血库提供), 每份5mL, 分别制成滤纸血痕。采用BSD-600型半自动血样打孔器, 将10份血痕分别打孔并制作等大圆形(1.2mm/片)血痕片各240片。
取同一样本血痕片6片作为一份一次实验用个体血痕样本, 可保证利用不同提取方法均可提取一定含量DNA, 以便比较提取方法对同一样本DNA提取的影响。
按联苯胺血痕预试验处理后干燥保存时间为30min、1h、3h、6h、12h、24h 六个实验组及一个试剂未处理样本对照组, 每组分别按磁珠提取法、QIAcube DNA提取纯化法、chelex-100提取法等三种提取方法提取DNA。
TECAN全自动操作平台(瑞士)、QIAcub全自动DNA提取仪(德国)、BSD-600型半自动打孔器(澳大利亚)及9700型PCR扩增仪、7500型荧光定量PCR仪、3130XL遗传分析仪均为美国AB公司产品。
联苯胺血痕预实验(Baso公司, 深圳)、EQ1000磁珠提取试剂盒(北京东胜创新公司)、DNA Investigator试剂盒(德国Qiagene公司)、chelex-100(100m~200m, 美国Bio-rad公司)及Quantifiler Human DNA Quantification Kit试剂盒、Identifiler plus试剂盒、3130XL电泳相关试剂均为美国AB公司产品。
1.3.1 联苯胺血痕预实验检测 参考文献[7], 采用联苯胺血痕预实验滤纸片检测法, 检测每一份血痕样本, 并让其在滤纸上自然干燥。
1.3.2 样本DNA提取 参考文献[7, 8, 9], 分别采用磁珠提取法、QIAcube DNA提取纯化法、chelex-100提取法3种方法, 提取不同保存时间样本DNA。
1.3.3 PCR-STR检测 参考文献[10], 应用Identifiler plus试剂盒, 对不同提取方法提取不同干燥保存时间样本DNA进行STR分型检测。设定有13个以上清晰、完全相同的STR基因座分型视为样本的有效DNA分型, 余均视为无效DNA分型。
1.3.4 荧光定量PCR检测 参考文献[10], 应用Quantifiler Human DNA Quantification 试剂盒, 对不同提取方法提取不同干燥保存时间样本DNA进行定量检测, 用7500 荧光定量PCR 仪进行扩增及检测, 采用7500 System SDS Software v1.2.3 分析数据。
采用SPSS 19.0软件对样本DNA进行均数及标准差计算、线性对数回归分析、方差分析, 比较联苯胺血痕预试验试剂处理样本后不同DNA提取方法、不同保留时段的DNA含量之间的差异。当P< 0.05时, 表明差异具有显著性。
3种不同DNA提取方法、6组联苯胺血痕预试验试剂处理后保存时间样本, 试验样本共有180份, Identifiler plus检测分型获完整、明确16个STR基因座DNA分型样本15份, 占8.33%; 获得13-15个STR基因座DNA分型样本23份, 占12.78%; 其余样本未获明确有效DNA分型。
STR分型具有以下特征:(1)样本处理6h以上, 部分大片段基因座无明确DNA分型样本增加; (2)未获明确有效DNA分型样本中部分基因座易出现等位基因的丢失现象, 主要在D7S820、D13S317、D16S539、TPOX、FGA等基因座, 142个样本中出现232个基因座有等位基因丢失, 有的样本中甚至同时有7个基因座出现等位基因丢失现象; (3)处理时间较短样本(30min内)有75%样本可获得有效DNA分型; 出现明确DNA分型38个样本中, 三种DNA提取方法(磁珠提取法、QIAcube DNA提取纯化法、chelex-100提取法)获明确STR分型的样本个数分别为13, 13, 12(见表1, 表2和图1)。
| 表1 联苯胺血痕预试验后不同DNA提取法STR分型情况 |
| 表2 联苯胺血痕预试验后样本STR分型谱带丢失情况 |
采用7500型荧光定量PCR检测方法, 对3种不同DNA提取方法、6组试剂处理后试验样本及正常对照样本共210份检材进行DNA含量检测, 标准扩增曲线Ct值为29, 其r2值为0.9917, 不同分类检材DNA平均含量结果见表3。
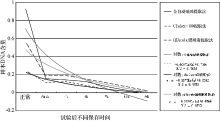
分析同一提取方法、不同处理样本保存时间的样本DNA平均含量, 显示随时间延长含量逐渐降低的趋势, 在24h内呈现一定的相关性, 其线性对数回归方程为(见图2):
磁珠提取法, Y=-0.4087ln(x)+0.7044
R2=0.7633;
QIAcube DNA提取纯化法, Y=-0.2393ln(x)+0.4764 R2=0.8715; chelex-100提取法, Y=-0.1178ln(x)+0.2302 R2=0.9571。
DNA含量检测结果显示, 联苯胺血痕预试验后样本DNA含量均有不同程度降低, 经因素方差分析, 降低含量差异呈极显著性, 且随着试剂处理时间的延长, DNA含量越低; 同样, 联苯胺血痕预试验试剂处理后样本在同一保存时间, 应用不同DNA提取方法, DNA含量也不同, 采用方差分析, P< 0.01, 差异也呈现出极显著性。说明提取方法也是决定样本DNA含量关键因素之一。
| 表3 联苯胺血痕预试验后3种DNA提取方法所得DNA含量的比较 |
Saferstein(2004)[11]认为, 理想的血痕预试验的试剂应具有以下几个特征:(1)高特异性; (2)灵敏度高; (3)对检验DNA的损伤小, 包括对DNA的片段长度及DNA的完整性两个方面; (4)便于运输与携带; (5)便于操作; (6)便于保存。其中以灵敏度高和对检验样本DNA的损伤小最为重要。联苯胺血痕预实验灵敏度极高, 但评价其应用价值, 对处理后检材进行DNA含量检测和STR分型是非常重要的内容。
经7500荧光DNA定量检测, 比较正常对照、试剂处理后不同保存时间血样, 显示处理血痕后的样本DNA含量明显下降, 不同保存时间样本DNA含量差异呈极显著性, 在24h内呈现一定的线性相关性, 试验处理后样本保存时间越长, 样本DNA含量越低, 说明联苯胺试验对样本DNA损伤明显。
试剂处理后样本进行STR检验, 显示获13个STR有效分型样本仅为21.11%, 其中获16个STR分型的样本仅占8.33%, 且多为试剂处理30min内的检材; 同时, 未获明确有效DNA分型样本中部分基因座易出现等位基因杂合性丢失(LOH)现象, 142个样本中出现232个基因座有等位基因的杂合性丢失, 甚至有的样本中同时有7个基因座出现等位基因杂合性丢失现象。
可见, 联苯胺试剂处理可疑血样易造成DNA的错误分型, 在实际案件检测中, 建设对联苯胺血痕预试验处理可疑血痕样本不能对其进行STR分型检测, 以免误判。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|